��Ŀ����
����Ŀ���ѣ�Ti�� ��Ϊ����������������ܶ�Խ��Խ�������ǵĹ�ע����ѧ��ȤС���Mg��Ti��Ag�Ľ������˳�����̽����
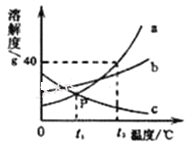
[�������]a��Ti�Ľ�����Ա�Mgǿ��
b��Ti�Ľ�����Խ���Mg��Ag֮�䡣
[��������]����ͬ�����£��������ᷴӦ���������ݵ�����Խ�죬��ý������Խǿ��
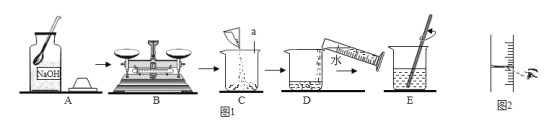
[ʵ�����]ͬ���£�ȡ��С��ͬ�������ֽ�����Ƭ���ֱ�Ͷ����������Ũ�ȵ�����ϡ�����У��۲�����
��ش����ֽ�����������ǰ������ɰֽ���������������Ŀ����_______��
[ʵ������]

[ʵ�����]ԭ������________����ȷ��������___________��
[��˼]�ò�ͬŨ�ȵ�����ϡ���ᷴӦ���Ƿ�Ҳ�ܵó�ͬ������?_____��˵������_______��
���𰸡���ȥ����Ĥ������ֱ�ӷ�Ӧ���ų�������Է�Ӧ�ٶȵ�Ӱ�� a ����þ�����ᷴӦ�������ݵ��ٶ����Կ����� �� ��Ӧ�����뷴Ӧ��Ũ���й�
��������
��1����ʹ�ý������������ʷ�Ӧʱ��Ҫ��ɰֽ���������������ȥ����������������ֹ�Է�Ӧ��Ӱ�졣
��2���ӷ�Ӧ�������Աȣ������ᷴӦ�ǻ����ģ���þ���ᷴӦ��ǿ�ҵģ�˵��þ���ѵĻ��Ҫǿ����a����ȷ��
��3���ò�ͬŨ�ȵ�����ϡ���ᷴӦ�����ܵó���ͬ�Ľ��ۣ���Ϊ��Ӧ��Ũ�Ȳ�ͬ����Ӧ����Ҳ��ͬ��

 ������ϵ�д�
������ϵ�д� �żӾ���ϵ�д�
�żӾ���ϵ�д�����Ŀ��ʵ������һƿ���ܲ������Լ�����ͼ�������ȱ�ı�ǩ��ֻʣ����Na������10%����������֪������ɫҺ�壬�dz��л�ѧ���õ��Լ���Сǿ��С��ͬѧ�ܸ���Ȥ����������ɷֽ���̽����
��������⣩��ƿ�Լ�������ʲô��Һ�أ�
���������ۣ����������ǩ������жϣ���ƿ�Լ����������� ����
A���� B���� C����
���������ϣ�
�������л�ѧ�����ĺ��ƻ�������NaCl��NaOH��Na2CO3��NaHCO3��
����Na2CO3��NaHCO3��Һ���ʼ��ԡ�
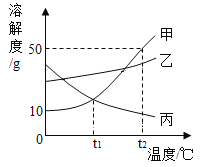
�����ⶨ���£�20����ʱ���������ʵ��ܽ�ȵ��������£�
���� | NaCl | NaOH | Na2CO3 | NaHCO3 |
�ܽ��/g | 36 | 109 | 215 | 9.6 |
���ó����ۣ�С�������Լ�ƿ��ע��������������10%���ϱ��е��ܽ�ȵ������жϣ���ƿ�Լ����������� ����
���������룩���������� ����Һ����������Na2CO3��Һ����������NaCl��
����Ʋ�ʵ�飩
��1��Сǿ�ýྻ�IJ�����պȡ����Һ����pH��ֽ�ϣ����pH��7����ƿ�Լ����������� ����
��2��СǿΪ�˼������Һ��NaOH��Һ����Na2CO3��Һ�����ֽ���������ʵ�飺
�������� | ʵ������ | ���ۼ���ѧ����ʽ |
ȡ�����Թ��У� | �� �� | ��������ȷ |