题目内容
海洋为我们提供了丰富的资源,二十一世纪是海洋开发与利用的世纪,请围绕“海洋”这个话题回答以下问题:
(1)下图1是我们从海水中提取镁的流程图: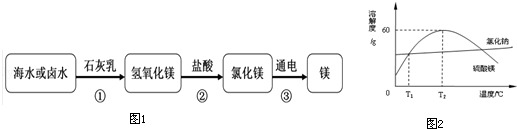
①上述一系列转化过程中,属于中和反应的是 (用化学方程式表示)
②海水制镁过程中对于如何富集镁离子,甲、乙、丙三位同学各自提出自己的设想:
甲:直接往海水中加入石灰乳.
乙:高温加热蒸发海水后,加入石灰乳.
丙:向晒盐后的卤水中,加入石灰乳.
通过分析比较,你认为 的设想最为经济合理(选填“甲”、“乙”或“丙”).
(2)关于海水“制碱”中得到的“碱”的成分,甲同学认为是氢氧化钠,乙同学认为是碳酸钠,为确定其成分,甲、乙同学各做了以下两个实验:
①甲向“碱”溶液中加入酚酞,观察到酚酞变红,于是认为“碱”是氢氧化钠.
②乙向“碱”溶液中加入氢氧化钙溶液,产生白色沉淀,于是认为“碱”是碳酸钠.
你同意 (填甲或乙)同学的观点,请指出另一个同学实验设计的不合理之处
(3)从海水晒盐留下的“苦卤”中加工得到不纯的硫酸镁晶体,其中含有少量氯化钠,根据溶解度曲线图2回答下列问题:
①t1℃时,等质量的水中最多溶解的硫酸镁质量 (填大于、小于或等于)最多溶解的氯化钠的质量.
②t2℃时,向50克水中加入50克硫酸镁,所得溶液的溶质质量分数是 .
③要除去少量的氯化钠,得到较纯净的硫酸镁,可采用的方法是 .
A.过滤
B.蒸干水分
C.将t2℃硫酸镁的饱和溶液升温,析出晶体后过滤.
(1)①Mg(OH)2+2HCl═MgCl2+2H2O;②丙;
(2)乙;碳酸钠溶液也呈碱性,可以使酚酞变红;
(3)①等于.②37.5%;③C.
解析试题分析:(1)①分析图1中的实验流程可以知道,属于中和反应的为氢氧化镁和稀盐酸的反应,该反应生成了氯化镁和水,其化学方程式为:Mg(OH)2+2HCl═MgCl2+2H2O。
②三种方式中甲需要大量的石灰乳,乙则需要加热消耗能量,只有丙的方式中由于水分的蒸发,而能够节约原料和能源,所以丙同学的方案最可行。
(2)碳酸钠溶液也呈碱性,可以使酚酞变红,所以不能根据酚酞变红就判定为氢氧化钠,即乙同学的操作正确。
(3)①比较图2中的溶解度曲线可以知道t1℃时,氯化钠和硫酸镁的溶解度相等,所以该温度下等质量的水中最多溶解的硫酸镁质量等于最多溶解的氯化钠的质量。
②t2℃时,硫酸镁的溶解度为60g,根据溶解度的定义可以知道,向50克水中加入50克硫酸镁,只能溶解30g,所以所得溶液的溶质质量分数是: ×100%=37.5%。
×100%=37.5%。
③分析图中曲线可以知道t2℃后,硫酸镁的溶解度随温度升高而降低,而氯化钠的溶解度随温度升高而升高,所以要提纯硫酸镁可以将t2℃硫酸镁的饱和溶液升温,析出晶体后过滤即得较为纯净的硫酸镁,故选C。
考点:本题考查对海洋资源的合理开发与利用;结晶的原理、方法及其应用;固体溶解度曲线及其作用;酸的化学性质;碱的化学性质;中和反应及其应用。

如图为某抗酸药的实物图,回答下列问题.
(1)图中标示的物质中,含有的金属元素是 (写出一种即可),属于有机合成材料的是 塑料 .
(2)淀粉属于 (填字母序号).
| A.蛋白质 | B.糖类 | C.油脂 | D.维生素 |
(4)另一种抗酸药的主要成分是三硅酸镁(Mg2Si3O8?nH2O),能与盐酸发生复分解反应,则反应后产物中含镁的化合物是 (填化学式).
从小明同学整理的笔记中可以看出,不正确的一项是 .
| A.除去NaOH溶液中的Ca(OH)2杂质,加入适量Na2CO3溶液,过滤 |
| B.用熟石灰改良酸性土壤 |
| C.NaOH+HCl═NaCl+H2O,属于复分解反应 |
| D.二氧化碳气体和氢气,分别通入无色酚酞试液都变红色 |