题目内容
【题目】实验探究、科学精神是我们应具备的学科素养。化学兴趣小组的同学对实验室制取二氧化碳进行探究,请你一起参与。
(查阅资料)(1)稀硫酸能与大理石反应,生成的硫酸钙微溶于水;
(2)稀盐酸显酸性,可使紫色石蕊溶液变红。
(选用药品)按下表进行实验,取等质量的大理石加入足量酸中(杂质不与酸反应),产生二氧化碳体积随时间变化曲线如下图所示:
实验编号 | 药品 |
Ⅰ | 块状大理石、10%H2SO4溶液 |
Ⅱ | 块状大理石、7%HCl溶液 |
Ⅲ | 大理石粉末、7%HCl溶液 |
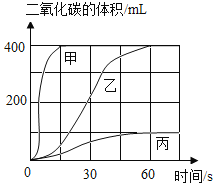
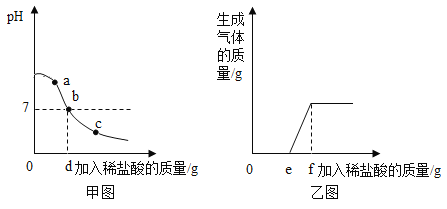
图中丙对应实验_________(选填” Ⅰ”、” Ⅱ”或” Ⅲ”)。确定用乙对应的药品制备二氧化碳,相应的化学方程式是___________;不选择甲对应的药品,理由是______________。
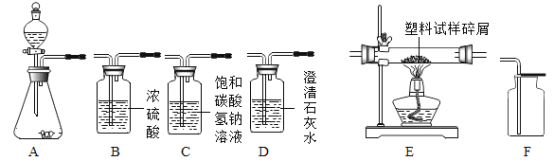
(选择仪器)小组同学从图 2 所示仪器中组装一套可控制反应速率的制取装置,你认为他们选择的仪器是__________(填序号)
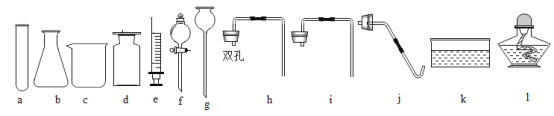
(收集气体)用如图装置收集二氧化碳,空气从_____________(选填”X”或”Y”)端排出。
(检验气体)检验产生的气体为二氧化碳的方法是_________________。
(拓展创新)实验结束后,小组同学对装置中的废液产生了兴趣,有同学认为可能稀盐酸有剩余,欲证明该猜想是正确的,可向废液中加入______________,会出现_________的现象。
【答案】I CaCO3+2HCl=CaCl2+H2O+CO2↑ 反应速率太快,不易收集 bdfh Y 将生成的气体通入澄清石灰水中,澄清石灰水变浑浊 碳酸钠(合理均可) 产生气泡
【解析】
碳酸钙和硫酸反应生成的硫酸钙微溶于水,会阻碍反应的继续进行,所以图中丙对应实验I;碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;甲反应生成二氧化碳的速率太快,所以不选择甲对应的药品,理由是:反应速率太快,不易收集;
[选择仪器]
分液漏斗可以控制液体的滴加速度,制取二氧化碳反应物是固体和液体,反应条件是常温,二氧化碳密度比空气大,所以选择的仪器是bdfh;
[收集气体]
二氧化碳密度比空气大,所以用图 3 装置收集二氧化碳,二氧化碳从X端进入,空气从Y端排出;
[检验气体]
二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,所以检验产生的气体为二氧化碳的方法是:将生成的气体通入澄清石灰水中,澄清石灰水变浑浊;
[拓展创新]
盐酸和碳酸钠反应会生成二氧化碳气体,会看到有气泡产生,所以有同学认为可能稀盐酸有剩余,欲证明该猜想是正确的,可向废液中加入碳酸钠,会出现产生气泡的现象。

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案【题目】“五一”假期,聪聪同学和家入到故宫去参观,发现故宫内许多铜制品表面有一层绿色物质。绿色物质是什么?它是怎样形成的?化学活动课上,同学们设计实验对这种绿色物质进行了如下探究活动。
[查阅资料]
①铜在空气易生成铜锈,它为绿色,其主要成分是Cu2(OH)2CO3;
②白色的硫酸铜粉末遇水能变为蓝色。
探究活动一:验证铜锈的组成。
[进行实验1]
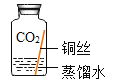
同学们设计了如图所示装置并进行实验。
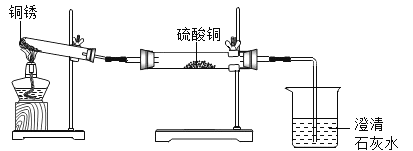
实验操作 | 实验现象 | 实验结论 |
①按上图组装仪器,装入药品。 ②加热铜锈,直至不再有气体产生。 | 绿色固体变为黑色,硫酸铜粉末变为蓝色,烧杯中液体变浑浊 | 加热铜锈生成的物质有CuO、_____,烧杯中发生反应的化学方程式为___________ |
③冷却后,向试管中黑色固体加入适量稀硫酸。 | 黑色固体溶解,溶液变为蓝色 |
探究活动二:探究铜生锈的条件。
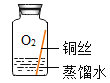
[进行实验2]
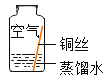
同学们进行了下面的4个实验,每天观察一次现象,一段时间后,发现只有实验4中的铜丝生锈了,且与水接触的部分生锈更明显。
序号 | 实验内容 | 实验现象与结论 |
实验1 |
| 在干燥环境中,铜不生锈 |
实验2 |
| 铜仅与氧气和水接触,不生锈 |
实验3 |
| 铜仅与二氧化碳和水接触,不生锈 |
实验4 |
| 铜生锈,它生锈的条件是___________________ |
/span>
[反思与拓展]
(1)实验2和3中使用的是经煮沸后迅速冷却的蒸馏水,其目的是__________________。
(2)如果要除去铜制品表面的铜锈,可以用稀盐酸浸泡,写出反应的化学方程式___________________。