题目内容
【题目】某同学将10g碳酸钙和氯化钙的混合物进行了如图实验,下列物质恰好完全反应,请计算:
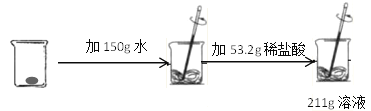
(1)生成CO2气体的质量____________g;
(2)反应后所得溶液中溶质质量分数为_______________。
【答案】 2.2g 5%
【解析】(1)该实验中只有碳酸钙与稀盐酸发生反应生成二氧化碳和水,根据质量守恒定律,生成二氧化碳的质量为150g+53.2g+10g-211g=2.2g
(2)设10g样品中碳酸钙的质量为x,生成氯化钙的质量为y
CaCO3+2HCl == CaCl2+H2O+CO2↑
100 111 44
x y 2.2g
![]() =
=![]() =
=![]() ,解得x=5g,y=5.55g反应后溶液中氯化钙的质量为5g+5.55g=10.55g
,解得x=5g,y=5.55g反应后溶液中氯化钙的质量为5g+5.55g=10.55g
反应后溶液中溶质的质量分数为![]() =5%
=5%
答:生成二氧化碳的质量为2.2g,反应后溶液中溶质的质量分数为5%。

 阅读快车系列答案
阅读快车系列答案【题目】根据下表数据回答问题:
温度(℃) | 0 | 10 | 20 | 40 | 60 | 80 | 100 |
NaOH溶解度(g/100g水) | 42 | 51 | 109 | 129 | 174 | 314 | 347 |
A溶解度(g/100g水) | 0.18 | 0.17 | 0.16 | 0.14 | 0.12 | 0.095 | 0.07 |
(1)NaOH的溶解度随温度变化的规律_____________________________________。
(2)在装有100g NaOH固体的小烧杯中,加入100g冰水并充分溶解后测定溶液温度为10℃,此时所得溶液为__________(选填“饱和”或“不饱和”)溶液。再将该烧杯放入盛有热水的大烧杯中,使溶液温度升至60℃,此时溶液中溶质与溶剂的质量比为____________。
(3)利用(2)中所得溶液进行如下实验:

①加入试剂A时发生反应的化学方程式为__________________________________;
②滤液1中含有的溶质是______________;操作Ⅱ的名称是__________________。