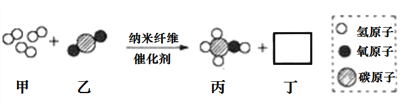
题目内容
【题目】根据下图中甲、乙、丙三种固体物质的溶解度曲线,回答下列问题。

(1)温度为_________℃时,甲、乙物质的溶解度相等。
(2)甲、乙、丙三种物质中,_______的溶解度受温度影响最小。
(3)分别将100g甲、丙的饱和溶液从t3℃降温到t1℃时,对所得溶液的叙述正确的___________(填序号)
A.甲、丙都是饱和溶液
B.所含溶剂质量:甲=丙
C.溶液的质量:甲>丙
D.溶质的质量分数:甲>丙
【答案】(1)t2 (2)乙 (3)D
【解析】(1)在溶解度曲线图上,横坐标是温度,纵坐标是溶解度。温度为t2℃时,甲、乙物质的溶解度相等。(2)由图可知,甲、乙、丙三种物质中,乙的溶解度受温度影响最小。(3)饱和溶液溶质的质量分数=溶解度÷(溶解度+100g)×100% 。分别将100g甲、丙的饱和溶液从t3℃降温到t1℃时,甲和乙的溶解度变小有晶体析出,得t1℃时的饱和溶液,t1℃时乙的溶解度大于甲的溶解度,丙在降温时溶解度变大,成为不饱和溶液,但溶质不变,等于t3℃时的溶解度,小于甲t1℃时的溶解度,,溶液中溶质的质量分数,甲>丙,但是溶液质量甲<丙;t3℃甲的溶解度比乙的大,等量溶液中,丙溶液中溶剂比甲溶液中的多。降温时溶剂质量不变,仍然丙溶液中溶剂比甲溶液中的多。

【题目】某兴趣小组同学对实验室制备氧气的条件进行如下探究实验。
(1)催化剂的种类与过氧化氢溶液分解速率是否有关呢?甲设计以下对比实验:
Ⅰ.将3.0g 10%H2O2溶液与1.0g MnO2均匀混合;
Ⅱ.将x g 10%H2O2溶液与1.0g CuO均匀混合。
在相同温度下,比较两组实验产生O2的快慢。
Ⅰ中反应的化学方程式是__________________________;
Ⅱ中x的值应为_____________g。
若Ⅰ产生氧气的速率比Ⅱ快,由此得出的实验结论是______________________。
(2)乙探究了影响过氧化氢溶液分解速度的某种因素。实验数据记录如下:
过氧化氢溶液的质量 | 过氧化氢溶液的浓度 | MnO2的质量 | 相同时间内产生O2体积 | |
Ⅰ | 50.0g | 1% | 0.1g | 9mL |
Ⅱ | 50.0g | 2% | 0.1g | 16mL |
Ⅲ | 50.0g | 4% | 0.1g | 31mL |
本实验中,测量O2体积的装置是______________(填编号)。
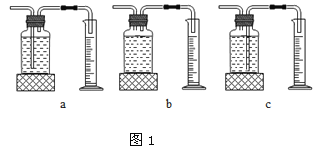
实验结论:在相同条件下,___________________,过氧化氢溶液分解得越快。
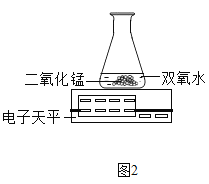
(3)丙用如图2装置进行实验,通过比较相同时间内____________也能达到实验目的。