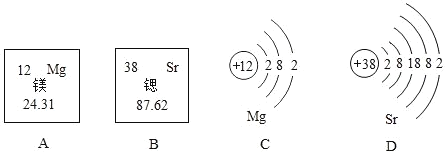
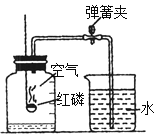
��Ŀ����
����Ŀ���±�����������ˮ���ұ��IJ������ݣ���������ˮˮ�ʳ��������Ŀ����ֵ�����֣�
��Ŀ | ��ֵ |
ɫ�� | ������15�ȣ������ó���������ɫ |
���Ƕ� | ������1�ȣ���������²�����5�� |
pH | 6.5��8.5 |
��Ӳ�ȣ���CaCO3�ƣ� | 450mg/L |
�� | 0.2mg/L |
�� | 0.3mg/L |
������ | 250mg/L |
��1���ϱ���������ָ����_____��ѡ��������������Ԫ��������ԭ��������
��2��������Ӳˮ�����ķ�����_____��
��3��ʵ����������ˮ��ͨ��ֽ⣬���������������������ԼΪ_____��
��4��������Ư�۵���Ч�ɷ���Ca(ClO)2��������Ԫ�صĻ��ϼ���_____��
��5��1L�ϸ����������ˮ�У�����CaCO3����Ӳ�ȣ����Ԫ�صĺ���������_____mg/L��
��6���ڳ��õľ�ˮ�ķ����У������̶���ߵ���_____
���𰸡�Ԫ�� ��� 2:1 +1 180 ����
��������
(1)����ˮ�е�����������ָԪ�أ�
(2) ��Ȼˮ��У�ˮ�еĿ����Ըơ�þ�����ת��������ˮ��Ӳ�Ƚ��͡������в�����еķ�����Ӳˮ������
(3)ˮͨ��������������������ǵ������Ϊ��2:1��
(4)Ca(ClO)2�и�Ԫ�صĻ��ϼ�Ϊ+2����Ԫ�صĻ��ϼ�Ϊ-2�����ݻ������У��������ϼ۴�����Ϊ��ԭ������Ԫ�صĻ��ϼ���x�ã�(+2)��1+2x+(-2)��2=0��x=+1 ������д��+1��
(5)�ɱ���֪��1L�ϸ����������ˮ�У���Ӳ�ȣ���CaCO3�ƣ���Ϊ450mg����Ԫ�صĺ���Ϊ��450mg��![]() =180mg����ˣ�1L�ϸ����������ˮ�У���Ԫ�صĺ���������180mg/L������д��180��
=180mg����ˣ�1L�ϸ����������ˮ�У���Ԫ�صĺ���������180mg/L������д��180��
(6)�ڳ��õľ�ˮ�ķ����У������ˮ���������������������������ˮֻ��ˮһ�����ʣ�����ˮ��Ϊ����ˮΪ�������˾����̶���ߵķ���������

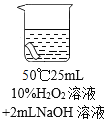
����Ŀ����Ưϴ��Һ�ܹ�ȥ������������ɫ֯���ȥ��Ч���ȼѡ�ͬѧ���ڶ����о�ʱ�������к��й������⣬�������Ϻ��֪����������Һ����Ư���ԣ���Ư��һЩ��ɫ���ʣ�ʵ��С��Թ�����������ʽ�����̽����
��.���ȶ���
���������ڳ����±��ֽܷ⣬���ʢ�Ź���������Һ���Լ�ƿ�ڱڻ���һЩС�����ݣ��䷢����Ӧ�Ļ�ѧ����ʽ��_______________,ʵ��С���ͬѧ��ù���������Һ�м��������������������ֲ������ݵ��ٶȱ���ˣ���ʵ��_______(�ܡ�����)˵���������ǹ�������ֽ�Ĵ�����
��.Ư����

[�������]���������Ư��������Щ�����й�?
[���в���]ͨ���Ķ�������ϣ�����Ϊ���������Ư���Կ�����________��________�������йء�
[����ʵ��]
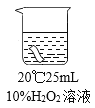
ʵ��1:��������10%�Ĺ���������Һ����һ���ɫ����������ʱ���벼����ɫ�仯
���±�:
����ʱ�� | 20 min | 40min | 60 min |
������ɫ�ı仯 | �����Ա仯 | ��ɫ�Ա�dz | ��ɫ���Ա�dz |
ʵ��2:����ɫ�����ֱ����������3����Һ�У��������±���
��� | �� | �� | �� |
ʵ�� |
|
|
|
������ɫ |
| ��ɫ�Ա�dz | ��ɫ���Ա�dz |
[���������]
��1��ʵ��1��Ŀ����__________________��
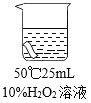
��2��ʵ��2�У����ó�������������ͬʱ�������¶ȿ�ʹ����������Һ��Ư������ǿ���Ľ��ۣ���Ҫ�Ա�ʵ��_________________(����)��
��3��ʵ��2�У�ͨ���ԱȢڢ۵ó��Ľ�����:����������ͬʱ,___________��
��4����������ʵ��,�Ʋ⡰ʹ�ò�ƯҺʱˮ�²��˳���50C����ԭ����___________________��