题目内容
【题目】在一堂化学实验课上,老师为每组同学分别提供了一瓶氢氧化钠溶液,让他们用1%的稀盐酸来测定其溶质的质量分数。以下是几组同学的设想及做法:
(1) 甲组同学的实验如下图所示:在烧杯中加入5g氢氧化钠溶液,滴入几滴酚酞溶液,用滴管慢慢滴入1%的稀盐酸,并不断搅拌,至溶液颜色恰好变为无色为止。
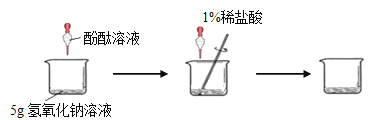
请回答:
①酚酞溶液的作用是 ;
②滴加稀盐酸时,用玻璃棒不断搅拌的目的是 ;
③当溶液颜色恰好变为无色时,共用去了稀盐酸73g,则甲组这瓶氢氧化钠溶液中溶质的质量分数为 ;
(2) 乙组同学的设想是:在烧杯中加入一定量的氢氧化钠溶液,用滴管慢慢滴入1%的稀盐
酸,并不断搅拌,通过用pH试纸多次测定溶液pH的办法,达到实验目的。
①下列使用pH试纸的方法正确的是 (填字母);
A.将pH试纸直接插入待测液中
B.将pH试纸放在干净的白瓷板上,用玻璃棒蘸取待测液滴在pH试纸上
C.将pH试纸润湿后放在玻璃片上,用玻璃棒蘸取待测液滴在pH试纸上
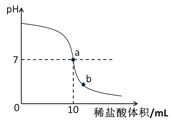
②由于用pH试纸所测数值不够精确。在老师指导下,乙 组同学取了5g氢氧化钠溶液进行了数字化实验,由计算机描绘出了整个实验过程中溶液pH的变化图像(简单表示为右图)。请回答:图中a点表示的含义是 ;b点溶液中含有的溶质有 ;乙组同学要计算出本组这瓶氢氧化钠溶液中溶质的质量分数,除了要用到已有数据外,你认为还需要的数据是 ;
(3) 丙组同学在滴加稀盐酸一段时间后,发现溶液中有少量气泡产生。这一“异常现象”激起了他们的探究欲望,通过实验证明:该组所用氢氧化钠溶液已经变质。请用化学方程式表示其变质原因 ;若要除去该溶液中的杂质,请简要写出你的实验方案: 。
【答案】(1)指示酸碱什么时候恰好完全反应;使混合均匀,反应充分;16%(2)①B;②HCl与NaOH恰好完全反应;NaCl、HCl;稀盐酸的密度;(3)2NaOH+CO2=Na2CO3+H2O;逐滴加入石灰水至刚好不再产生沉淀,过滤。
【解析】
试题分析:中和反应中酚酞溶液的作用是指示酸碱什么时候恰好完全反应;;滴加稀盐酸时,用玻璃棒不断搅拌的目的是使混合均匀,反应充分。;当溶液颜色恰好变为无色时,共用去了稀盐酸73g,设甲组这瓶氢氧化钠溶液中溶质的质量为X
NaOH+ HCl= NaCl+ H2O;
40 36.5
X 73克*1%
列比例式得:40:X=36.5:73克*1% X=0.8克 氢氧化钠溶液中溶质的质量分数为=0.8克/5克*100%=16%,使用pH试纸的方法正确的是:将pH试纸放在干净的白瓷板上,用玻璃棒蘸取待测液滴在pH试纸上,根据实验过程中溶液pH的变化图像看:图中a点表示的含义是HCl与NaOH恰好完全反应;b点溶液中含有的溶质有NaCl、HCl,因为此时的PH值是小于7,说明酸过量;要计算出本组这瓶氢氧化钠溶液中溶质的质量分数,除了要用到已有数据外,还需要的数据是稀盐酸的密度,没有密度无法计算其质量;丙组同学在滴加稀盐酸一段时间后,发现溶液中有少量气泡产生。通过实验证明:该组所用氢氧化钠溶液已经变质。化学方程式表示其变质原因2NaOH+CO2=Na2CO3+H2O;要除去该溶液中的杂质,请简要写出你的实验方案:逐滴加入石灰水至刚好不再产生沉淀,过滤,将碳酸钠除掉。

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案