题目内容
【题目】小明做“将浓硫酸滴到一小块布上”的实验,发现生成的炭上冒“白烟”,推测炭能与浓硫酸反应。欲探究其生成物成分,通过简单分析及实验确定无H2和O2,因此继续进行如下探究。
【查阅资料】①SO3能被浓硫酸及水吸收;
②SO2性质:能使品红褪色,能被高锰酸钾溶液吸收,能使澄清石灰水变浑浊;
③CO可与PdCl2溶液反应:PdCl2+CO+H2O===Pd(黑)↓+2HCl+CO2;不与KMnO4溶液反应。
【提出猜想】生成物的成分可能为;
Ⅰ.H2O、CO、SO2;Ⅱ.H2O、CO2、SO2;Ⅲ.H2O、CO、CO2、SO2。
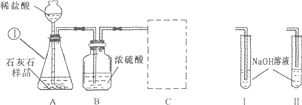
【实验验证】小明设计了如下实验:
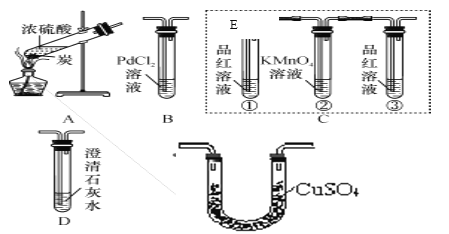
【分析讨论】
①根据实验目的,按气流从左到右的方向将实验仪器组装完整:A→_____→______→D →___。
②置E中所加药品是_________。
③置C中②的作用是除去SO2气体,则③试管中品红溶液的作用是_______________________。
④D中澄清石灰水变浑浊,方程式为_____________________________________________。
【实验结论】实验观察到的部分现象是:B中未见黑色沉淀,则猜想_____正确,
写出炭与浓硫酸在加热条件下反应的化学方程式_____________________。
【答案】 E C B 无水硫酸铜 检验二氧化硫是否被除尽 Ca(OH)2+CO2═CaCO3↓+H2O Ⅱ C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
【解析】【解答】【分析讨论】①根据题中所给物质的性质氯化钯能与一氧化碳反应故装置B用来验证生成物是有无一氧化碳气体;根据品红能与二氧化硫反应,且高锰酸钾溶液能吸收二氧化硫气体故装置C用来验证二氧化硫气体并吸收二氧化硫气体;根据三个猜想中都有水蒸气,故可推测E装置是用来验证产物中是否有水蒸气,验证水蒸气一般用无水硫酸铜,验证物质成份时要先验证是否有水以防止再生成的水产生干扰,故A装置先连接E装置,根据一氧化碳与氯化钯反应能生成二氧化碳故验证二氧化碳要在验证一氧化碳之前,故最后一空是B,由此可得出正确的顺序是:A→E→C→D→B;②由以上分析可知E中的药品作用是为了验证产物中是否有水故应选用无水CuSO4,故填:无水硫酸铜;检验产物中是否有水生成;③C装置中第一个试管中的品红是为了验证产物中是否有二氧化硫气体,二氧化硫也能使澄清石灰水变浑浊,故验证二氧化碳之前要将二氧化硫气体除净,所以C装置中的高锰酸钾是用来吸收二氧化硫气体的,第三个试管中的品红显然是为了检验二氧化硫是否被除净了;④二氧化碳能使澄清的石灰水变浑浊,二者反应的化学方程式为:Ca(OH)2+CO2═CaCO3↓+H2O;【实验结论】由B中未见黑色沉淀,说明生成物中没有一氧化硫,故猜想II 正确;根据猜想II的生成物书写碳和浓硫酸反应的化学方程式为:C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。

 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案