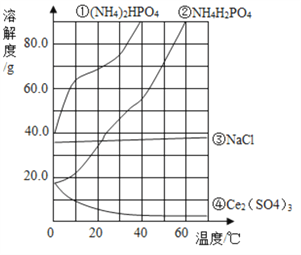
题目内容
【题目】为解决水中氧气不足的问题,通常向鱼池中撒一种微黄色的固体,这种固体的主要成分是过氧化钙(CaO2),CaO2与Na2O2都属于过氧化物,它们的化学性质非常相似。过氧化钠与水反应的化学方程式是:2Na2O2+2H2O=4NaOH+O2↑
⑴写出CaO2与H2O反应的化学方程式______________________________________;
⑵现称取20g样品加入到足量的水中,结果生成3.2g O2(样品中其它成分与水不反应)。请计算该样品中CaO2的质量分数___________。
【答案】 2CaO2+2H2O=2Ca(OH)2+O2↑ 72%
【解析】本题考查了化学方程式的书写与计算。
(1)过氧化钠与水反应生成氢氧化钠和氧气,根据“CaO2与Na2O2都属于过氧化物,它们的化学性质非常相似”,可推断过氧化钙与水反应生成氢氧化钙和氧气;化学方程式是:2CaO2+2H2O=2Ca(OH)2+O2↑;
(2)设20g样品中CaO2的质量为x
2CaO2+2H2O=2Ca(OH)2+O2↑
144 32
x 3.2g
![]() x=14.4
x=14.4
该样品中CaO2的质量分数=![]() ×100%=72%
×100%=72%
答:该样品中CaO2的质量分数为72%。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目