题目内容
【题目】实验课上,同学们发现一瓶久置空气中的氢氧化钠固体的瓶口有白色粉末。在老师指导下,同学们对该白色粉末的成分进行了探究。
(猜想与假设)猜想1:白色粉末是碳酸钠。
猜想Ⅱ:白色粉末是氢氧化钠。
猜想Ⅲ:白色粉末是_____。
(查阅资料)CaCl2溶液、Ca(NO3)2溶液呈中性。
(实验探究)取该白色粉末溶于水形成溶液A,设计如下实验:
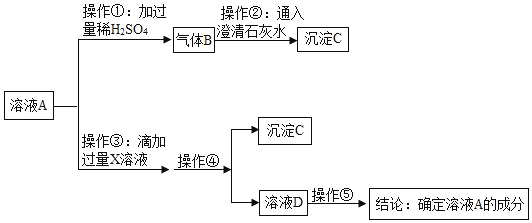
(1)由上述实验可知,猜想_____肯定不成立。
(2)若操作①滴加过量稀硫酸有气体B产生,而滴加少量稀硫酸可能没有气体B生成,其可能的原因是_____(用化学方程式回答)。
(3)适宜操作③的X溶液是_____(填字母序号)
A CaCl2溶液 B Ca(OH)2溶液
C Ba(OH)2溶液 D Ca(NO3)2溶液
(4)操作④需要用到的玻璃仪器是_____。
(5)请写出操作⑤的两种方案并得出结论。
方案一:_____。
方案二:_____。
【答案】碳酸钠和氢氧化钠 Ⅱ 2NaOH+H2SO4═Na2SO4+2H2O AD 烧杯、漏斗、玻璃棒 滴加酚酞试液,酚酞试液变红色,说明溶液A中含有氢氧化钠 滴加氯化镁溶液,产生白色沉淀,说明溶液A中含有氢氧化钠
【解析】
氢氧化钠可能没有变质、可能部分变质、可能完全变质。没有变质只有氢氧化钠,部分变质是氢氧化钠和碳酸钠的混合物、完全变质是碳酸钠。检验碳酸根离子可以确定是否变质,检验是否有氢氧化钠可以确定是部分变质还是完全变质。
1、【猜想与假设】
猜想Ⅲ:部分变质:白色粉末是碳酸钠和氢氧化钠。
2、【实验探究】
(1)由上述实验可知,加入稀硫酸时产生气体,说明溶液中含有碳酸钠,猜想Ⅱ肯定不成立。
故填:Ⅱ。
(2)若操作①滴加过量稀硫酸有气体B产生,而滴加少量稀硫酸可能没有气体B生成,其可能的原因是溶液中含有氢氧化钠,稀硫酸先和氢氧化钠反应生成硫酸钠和水,反应的化学方程式为:2NaOH+H2SO4═Na2SO4+2H2O。
(3)适宜操作③的X溶液是氯化钙溶液或硝酸钙溶液。故填:AD。
(4)操作④是过滤,需要用到的玻璃仪器是烧杯、漏斗、玻璃棒。故填:烧杯、漏斗、玻璃棒。
(5)操作⑤的两种方案:
方案一:滴加酚酞试液,酚酞试液变红色,说明溶液A中含有氢氧化钠。
方案二:滴加氯化镁溶液,产生白色沉淀,说明溶液A中含有氢氧化钠。
故填:滴加酚酞试液,酚酞试液变红色,说明溶液A中含有氢氧化钠;滴加氯化镁溶液,产生白色沉淀,说明溶液A中含有氢氧化钠。

【题目】稀盐酸与氢氧化钠溶液混合后,发现溶液仍为无色。为了证明她们确实发生了化学反应,某学习小组进行如下实验:
|
|
图1 | 图2 |
| |
图3 | |
① 图1中从a→b整个实验过程中观察到的现象是_________________,由此证明上述实验过程确实发生了化学反应。
② 图2表示反应过程中溶液的PH变化情况,c点表示的意义是________________;当溶液的pH=2时,此溶液的溶质有_______________。
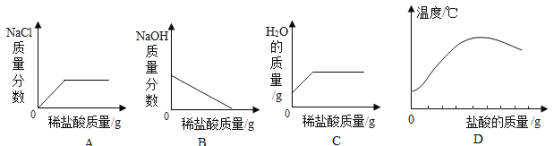
③ 图3表示向一定量的氢氧化钠溶液中逐滴加入稀盐酸至过量,图像中能正确反应对应变化关系的是________________。
④ 为测定氢氧化钠溶液的质量分数,取氢氧化钠溶液50g,用10%的稀盐酸进行测定,当加入稀盐酸为36.5g时恰好完全反应。
I. 稀盐酸中含HCl的物质的量是_____mol;
II. 氢氧化钠溶液的质量分数是___________。(根据化学方程式列式计算)
【题目】某兴趣小组对石灰石样品进行如下实验取12g样品放入烧杯中,将100g稀盐酸分4次加入到烧杯中,充分反应后(杂质不溶于水,也不与酸反应),测得剩余固体的质量记录如下。请计算:
次数 | 1 | 2 | 3 | 4 |
加入稀盐酸的质量/g | 25 | 25 | 25 | 25 |
剩余固体的质量/g | 8 | 4 | 2 | 2 |
求:
(1)样品中碳酸钙的质量为_____g:
(2)第4次加入稀盐酸后所得溶液中CaCl2的质量分数_______。(写出计算过程,最终结果保留0.1%)。
【题目】探究影响化学反应速率的因素。
(1)[发现和提出问题]
镁在空气中能够剧烈燃烧,铁丝在氧气中能够剧烈燃烧,而真金不怕火炼,这说明决定物质之间能否发生反应以及反应速率的内因是______。蜡烛在氧气中燃烧比在空气中燃烧剧烈,这一事例中影响化学反应速率的因素是______;夏天,将食品放在冰箱里不容易变质,这一事例说明温度也能影响化学反应速率。温度如何影响反应速率呢?
(2)[猜想与假设]
温度越高,反应速率越快。
(3)[收集证据]
实验药品:颗粒大小相同的锌粒:两份相同溶质质量分数、不同温度的稀硫酸(20℃、40℃)。
供选仪器:药匙、气体发生装置2套(气密性良好)、量筒2支、分液漏斗、秒表、胶头滴管、水槽、大试管2支。
利用上述仪器和药品,补充完成下表的实验报告。
观察或测量的量 | 实验步骤 | 实验现象 | 实验结论 |
产生相同体积(一试管)的气体所需要的时间 | ①分别取相同数量(或质量)锌粒于两套气体发生装置中 ②______ ③记录收集一试管气体所需的时间 | ④______ | 温度越高、反应速率越快 反应的化学方程式是 ⑤______ |
(4)[结论与解释]
从微观的角度分析“温度越高,反应速率越快"的原因是___________。
(5)[拓展分析]
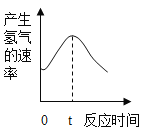
根据其他测定方法,实验小组的同学绘制了锌粒与稀硫酸反应产生氢气的速率随时间变化的曲线,如图所示。请据图分析:时间0-t内,反应速率逐渐加快的主要原因是________,时间t以后,反应速率逐渐减慢的主要原因是________________。