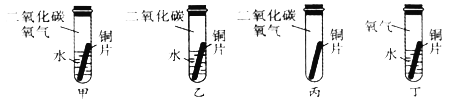
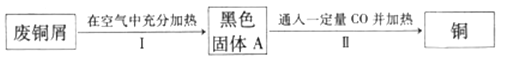
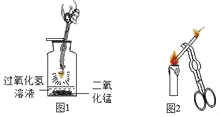
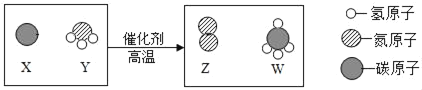
题目内容
【题目】ZnSO4 饱和溶液的溶质质量分数随温度变化的曲线如图所示。说法正确的是
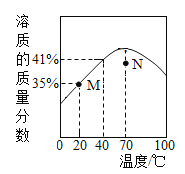
A. M 点对应的 ZnSO4 溶液是不饱和溶液
B. N 点对应的 ZnSO4 溶液升温或降温均都可能析出晶体
C. ZnSO4 饱和溶液的溶质质量分数随温度升高而增大
D. 40℃时,ZnSO4 的溶解度为 41g/100g 水
【答案】B
【解析】
A、M点在溶解度曲线上,对应的ZnSO4溶液是饱和溶液,故A错误;
B、通过分析溶解度曲线可知,N点对应的ZnSO4溶液升温或降温均都可能析出晶体,故B正确;
C、通过分析溶解度曲线可知,0℃-70℃,溶解度逐渐增大,大于70℃,溶解度逐渐减小,故C错误;
D、40℃时,ZnSO4的溶质质量分数为41%,所以溶解度应该是大于41g,大约是69.5g,故D错误。
故选B。

 名校课堂系列答案
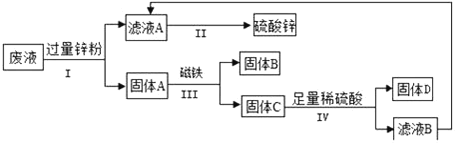
名校课堂系列答案【题目】合金在生活中应用十分广泛.已知某合金粉末除含铝外,还含有铁、铜中的一种或两种.小明利用如图装置对合金粉末中铁、铜的存在进行探究时,误把氢氧化钠溶液当成稀硫酸加入到锥形瓶中,他惊奇的发现有无色气体放出,注射器活塞向右移动.
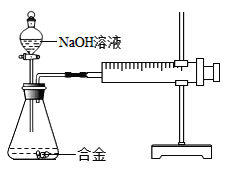
(提出问题)难道NaOH溶液也能与某些金属发生化学反应吗?
(查阅资料)(1)铝能与氢氧化钠溶液反应,铁、铜不能与氢氧化钠溶液反应.
(2)铝与氢氧化钠溶液反应的化学方程式为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑(NaAlO2溶于水,溶液显无色)
(进行猜想)猜想1:该合金粉末中除铝外,还含有铁.
猜想2:该合金粉末中除铝外,还含有_____.
猜想3:该合金粉末中除铝外,还含有铁、铜.
(实验探究)下列实验(见表1)仅供选用的试剂:20%的硫酸溶液、30%的NaOH溶液.
表1实验记录
实验步骤 | 实验现象 | 结论 |
①取一定量的合金粉末,加过量的_____,充分反应后过滤,滤渣备用 | 粉末部分溶解,并有无色气体放出 | 合金中一定含有_____. |
②取步骤①所得滤渣,加过量_____,充分反应 | 滤渣部分溶解,并有无色气体放出,溶液呈浅绿色 | 合金中一定含有 _____ |
(得出结论)猜想3成立.
(反思)
一般来说,活泼金属能与稀硫酸等酸反应,而铝与酸、碱都能反应,说明铝具有特殊的性质.若小明向合金粉末中加入的是足量的稀硫酸,则最终剩余的固体成分是_____.
(拓展与分析)请你设计一个实验方案,比较铝、铁、铜的金属活动性强弱_____.
【题目】下表是NaCl、KNO3在不同温度时的溶解度,根据数据回答。
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度 | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
(g/100g水) | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 |
①氯化钠的溶解度受温度变化的影响_____(填“很大”或“很小”)。
②50℃时,KNO3的溶解度_____(填“<”、“>”或“=”)NaCl的溶解度;向烧杯中加入100g水和49.0gKNO3固体配成50℃的溶液,再冷却到20℃,烧杯中析出固体的质量为_____g。
③KNO3中混有少量的NaCl,提纯的方法是_____(填“降温结晶”或“蒸发结晶”)。
④要比较NaCl和KNO3在水中的溶解性强弱,测定的数据可以是:相同温度下,等质量的溶质完全溶解达到饱和时所需水的质量;或_____。
⑤如图是有关硝酸钾溶液的实验操作及变化情况,说法正确的是_____(填编号)。
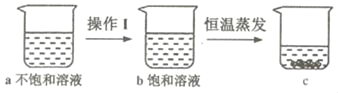
A 操作I一定是降温
B a与b的溶剂质量可能相等
C a与c的溶质质量一定相等
D b与c的溶质质量分数一定相等