题目内容
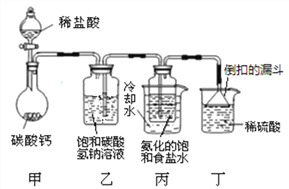
【题目】加热氯酸钾和二氧化锰的混合物可制备氧气,该反应的化学方程式为____________________,但实验中发现有刺激性气味的气体产生。
(提出问题)刺激性气味的气体是什么呢?
(猜想假设)猜想一:臭氧(化学式为O3) 猜想二:HCl 猜想三:Cl2
同学们认为不需要实验验证就可以判断猜想_______________是错误的,理由为_______________。
(查阅资料)(1)C12+H2O===HC1O+HCl。
(2)臭氧在MnO2存在的情况下极易分解成氧气。
(3)氯气可使湿润的淀粉碘化钾试纸变蓝。
(实验探究)
查阅资料后大家认为猜想一是错误的,理由为____________________________。他们进一步又做了如下实验:取氯酸钾和二氧化锰的混合物放人试管中加热,将蘸有硝酸银溶液的玻璃棒伸入试管口(如图),看到的现象是_____________,再将湿润的淀粉碘化钾试纸悬于试管口,试纸变_______________色,最终证明猜想三正确。
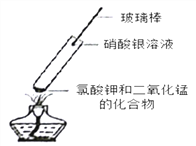
(反思拓展)
(1)欲证明二氧化锰是氯酸钾分解的催化剂,需证明二氧化锰的________、________在反应前后不变。
(2)自来水厂常用氯气来杀菌消毒,氯气和水反应后会产生H+、Clˉ和ClOˉ,而野外常用漂白粉[主要成分化学式为Ca(ClO)2]。你认为在水中起杀菌消毒作用的离子是_____________。
【答案】 2KClO3 ![]() 2KCl+3O2↑ 猜想二 反应物中没用氢元素 臭氧在MnO2存在的情况下极易分解成氧气 出现浑浊或者出现白色沉淀 蓝 质量 化学性质 ClO-
2KCl+3O2↑ 猜想二 反应物中没用氢元素 臭氧在MnO2存在的情况下极易分解成氧气 出现浑浊或者出现白色沉淀 蓝 质量 化学性质 ClO-
【解析】加热氯酸钾和二氧化锰的混合物可制备氧气,该反应的化学方程式为2KClO3 ![]() 2KCl+3O2↑ ;【猜想假设】不需要实验验证就可以判断猜想二是错误的,理由为:据质量守恒定律可知反应前后元素的种类不变,反应物中没用氢元素,不可能产生HCl ;【实验探究】由资料可知猜想一是错误的,因为臭氧在MnO2存在的情况下极易分解成氧气;C12+H2O===HC1O+HCl,氯化氢和硝酸银反应生成氯化银沉淀和硝酸。氯气可使湿润的淀粉碘化钾试纸变蓝。取氯酸钾和二氧化锰的混合物放人试管中加热,将蘸有硝酸银溶液的玻璃棒伸入试管口,看到的现象是硝酸银溶液出现浑浊(或出现白色沉淀),再将湿润的淀粉碘化钾试纸悬于试管口,试纸变蓝色,最终证明有氯气生成,即猜想三正确;【反思拓展】(1)催化剂就是能改变其他物质的反应速率而本身的质量和化学性质在反应前后都不改变的物质。欲证明二氧化锰是氯酸钾分解的催化剂,需证明二氧化锰的质量、化学性质在反应前后不变;(2)自来水厂常用氯气来杀菌消毒,氯气和水反应后会产生H+、Clˉ和ClOˉ,而野外常用漂白粉[主要成分化学式为Ca(ClO)2]。两种情况共同点是溶液中都有次氯酸根离子,所以在水中起杀菌消毒作用的离子是ClO-。
2KCl+3O2↑ ;【猜想假设】不需要实验验证就可以判断猜想二是错误的,理由为:据质量守恒定律可知反应前后元素的种类不变,反应物中没用氢元素,不可能产生HCl ;【实验探究】由资料可知猜想一是错误的,因为臭氧在MnO2存在的情况下极易分解成氧气;C12+H2O===HC1O+HCl,氯化氢和硝酸银反应生成氯化银沉淀和硝酸。氯气可使湿润的淀粉碘化钾试纸变蓝。取氯酸钾和二氧化锰的混合物放人试管中加热,将蘸有硝酸银溶液的玻璃棒伸入试管口,看到的现象是硝酸银溶液出现浑浊(或出现白色沉淀),再将湿润的淀粉碘化钾试纸悬于试管口,试纸变蓝色,最终证明有氯气生成,即猜想三正确;【反思拓展】(1)催化剂就是能改变其他物质的反应速率而本身的质量和化学性质在反应前后都不改变的物质。欲证明二氧化锰是氯酸钾分解的催化剂,需证明二氧化锰的质量、化学性质在反应前后不变;(2)自来水厂常用氯气来杀菌消毒,氯气和水反应后会产生H+、Clˉ和ClOˉ,而野外常用漂白粉[主要成分化学式为Ca(ClO)2]。两种情况共同点是溶液中都有次氯酸根离子,所以在水中起杀菌消毒作用的离子是ClO-。

 暑假作业海燕出版社系列答案
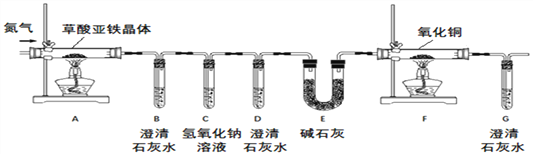
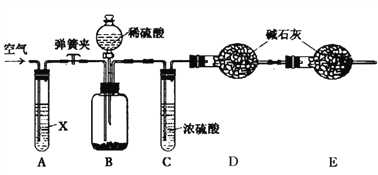
暑假作业海燕出版社系列答案【题目】草酸镍晶体(NiC2O4·2H2O)可用于制镍催化剂。某小组用废镍催化剂(成分为Fe2O3、Ni、Fe、SiO2等)制备草酸镍晶体的部分实验流程如下:
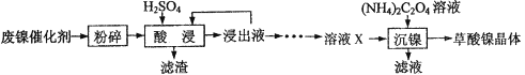
已知:①Ni能和稀H2SO4反应。
②相关金属离子生成氢氧化物沉淀的pH如下表:
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Ni2+ | 6.7 | 9.5 |
③H2O2能将Fe2+氧化为Fe3+
(1)废镍催化剂“粉碎”的目的是______。
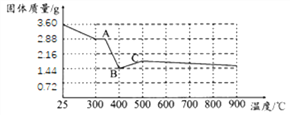
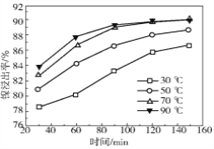
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如图,“酸浸”的适宜温度与时间分别为 _______(填字母)。
A.30℃、30min B.90℃、150min C.70℃、120min D.90℃、120min
(3)“酸浸”中发生的复分解反应方程式为________。
(4)“浸出液”得到“溶液x”过程中,加入试剂先后顺序是_____(填字母)。
A.先加H2O2溶液,再加NaOH溶液 B.先加NaOH溶液,再加H2O2溶液
加NaOH溶液调节pH_____(填范围),充分反应后得到滤渣的操作是______,该操作中所用到的玻璃仪器有玻璃棒、烧杯和_________。
(5)将“沉镍”工序:①主要过程为:蒸发浓缩、_____ 、过滤,所得固体用75%乙醇洗涤、110℃下烘干,得草酸镍晶体。
②用75%乙醇洗涤的目的是洗去杂质、___________;
③烘干温度不超过110℃的原因是______。