题目内容
【题目】有关CuSO4制备途径及性质如图所示。
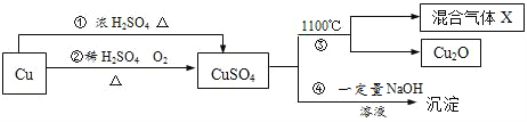
已知:
(1)Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。
(2)在一个化学反应中,如果有元素化合价升高,同时就有元素化合价降低。
下列说法正确的是
A. 途径②比途径①更好地体现绿色化学思想
B. 途径①中80g铜与200g98%浓硫酸反应可得到160g硫酸铜
C. 反应③分解所得混合气体X的成分是SO2和SO3
D. 若步骤4中所得沉淀为Cu(OH)2和CuSO4·3 Cu(OH)2,则沉淀中铜元素含量较CuSO4中铜元素含量大
【答案】AD
【解析】A.相对于途径①的铜和浓硫酸反应会生成二氧化硫气体污染空气,途径②的优点:制取等质量胆矾需要的硫酸少、途径②无污染性气体产生,更好地体现了绿色化学思想,故正确;
B.由方程式Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O可知每64份质量的铜与196份质量的硫酸反应生成160份质量的硫酸铜,80g铜与200g98%浓硫酸反应,铜过量,并且随着反应,浓硫酸会变为稀硫酸,反应将无法进行,不可得到160g硫酸铜,故错误;
CuSO4+SO2↑+2H2O可知每64份质量的铜与196份质量的硫酸反应生成160份质量的硫酸铜,80g铜与200g98%浓硫酸反应,铜过量,并且随着反应,浓硫酸会变为稀硫酸,反应将无法进行,不可得到160g硫酸铜,故错误;
C.硫酸铜分解生成Cu2O与氧气、SO3、SO2,根据2CuSO4═Cu2O+SO2↑+SO3↑+O2↑知,X可能是O2、SO2和SO3的混合气体,若只是二氧化硫和三氧化硫,铜元素、硫元素化合价只有降低,无元素化合价升高,故C错误;
D.将CuSO4中铜元素含量为![]() =40%,Cu(OH)2中铜元素含量为
=40%,Cu(OH)2中铜元素含量为![]() =65.3%,所以Cu(OH)2和CuSO4·3 Cu(OH)2混合物中铜元素含量在40%-65.3%之间,故正确。
=65.3%,所以Cu(OH)2和CuSO4·3 Cu(OH)2混合物中铜元素含量在40%-65.3%之间,故正确。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案【题目】某兴趣小组对某化学反应进行了探究,实验测定结果如下,下列说法正确的是
物质 | A | B | C | D |
反应前质量/g | 20 | 12 | 2 | 6 |
反应后质量/g | 0 | 2 | 2 | 待测 |
A.该反应是分解反应 B.反应后D物质的质量是30g
C.C物质可能是该反应的催化剂 D.以上说法均不正确
【题目】如图所示,某河旁甲、乙、丙、丁四座化工厂排放的工业废水中分别含有碳酸钠、氯化铜、氢氧化钠、盐酸中的一种。某同学对1、2、3、4处水质监测时记录了以下现象。
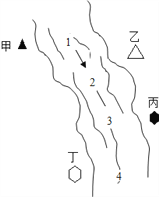
1 | 2 | 3 | 4 | |
记录现象 | 无色溶液 | 蓝色浑浊 | 浑浊消失 | 产生气泡 |
请回答下列相关问题:
(1)根据现象推断,甲、乙、丙、丁四座化工厂排放工业废水的成分,错误的是(________)
A.甲:碳酸钠 B.乙:氯化铜 C.丙:盐酸 D.丁:氢氧化钠
(2)若要检验甲厂排出的废水的酸碱性,可以选择的试剂是____________;
(3)2、3两处的化学方程式_______________________、_______________________。