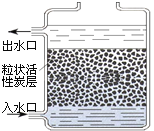
题目内容
【题目】多数金属是从矿石中提炼出来的。地壳中的金红石(主要成分为TiO2)与炭粉混合,通入氯气,高温条件下可制得TiCl4和一种可燃性气体,其化学方程式为________________________。向硝酸银、硝酸铜、硝酸镁的混合溶液中加入过量固体a,过滤后获得浅绿色滤液和固体,则此时滤液中溶质的名称是______________;若滤液显蓝色,则溶液中一定会发生的反应的化学方程式为______________________。
【答案】![]() 硝酸镁、硝酸亚铁
硝酸镁、硝酸亚铁 ![]()
【解析】
由于TiO2、C、Cl2混合物在高温条件下制得TiCl4和一种可燃性气体,根据化学反应中元素种类不变的规律可知:该可燃气体含有碳、氧两种元素,由碳、氧两种元素组成的可燃物只有一氧化碳。因此TiO2、C、Cl2混合物在高温条件下反应生成TiCl4和一氧化碳。该反应的化学方程式为:TiO2+2C+2Cl2![]() TiCl4+2CO.向硝酸银、硝酸铜、硝酸镁的混合溶液中加入过量固体a,过滤后获得浅绿色滤液和固体,说明加入的固体 a是铁粉,铁先与硝酸银反应生成银和硝酸亚铁,然后再与硝酸铜反应生成铜和硝酸亚铁,与硝酸镁不反应,所以滤液中的溶质是硝酸亚铁和硝酸镁;若溶液呈蓝色,说明其中含有硝酸铜,因此无法判断铁是否与硝酸铜发生反应,但是铁一定会与硝酸银反应,铁与硝酸银反应生成硝酸亚铁和金属银,反应的方程式为:
TiCl4+2CO.向硝酸银、硝酸铜、硝酸镁的混合溶液中加入过量固体a,过滤后获得浅绿色滤液和固体,说明加入的固体 a是铁粉,铁先与硝酸银反应生成银和硝酸亚铁,然后再与硝酸铜反应生成铜和硝酸亚铁,与硝酸镁不反应,所以滤液中的溶质是硝酸亚铁和硝酸镁;若溶液呈蓝色,说明其中含有硝酸铜,因此无法判断铁是否与硝酸铜发生反应,但是铁一定会与硝酸银反应,铁与硝酸银反应生成硝酸亚铁和金属银,反应的方程式为:![]() 。
。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案【题目】酸和碱在生产生活及科学研究中有着重要的作用。
(1)某危险品运输车辆发生交通事故,造成浓硫酸泄漏,消防官兵向事故现场撒入大量的白色粉末来做中和处理,以免发生由此造成的环境污染。请写出有关反应的化学方程式:______________________。
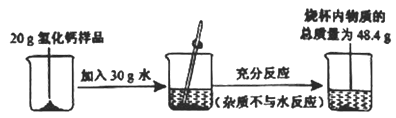
(2)化学兴趣小组的同学向盛有稀氢氧化钠溶液的烧杯中倒入一定量的稀盐酸时,没有观察到明显现象。同学们就此做了如下探究:
①小组同学对烧杯内溶液中的溶质成分进行了如下猜想,其中不合理的是______________________。
A 氢氧化钠、氯化氢 B 氯化钠 C 氯化钠、氯化氢 D 氯化钠、氢氧化钠
②为了证明氢氧化钠溶液和稀盐酸混合后确实发生了化学反应,甲同学设计如下实验,并把反应后的溶液蒸干,得到一些白色固体。
实验操作 | 实验现象 | 白色固体成分 |
取少量氢氧化钠溶液于试管中,离加2-3滴无色酚酞溶液,然后逐滴滴加稀盐酸,滴加几滴后用pH计测定溶液的酸碱度 | 溶液先显红色,pH >7 | _____ |
溶液后显无色,pH_______7 | NaCl |
结论:没有明显现象发生的化学反应,可以借助酸碱指示剂或pH计来确定反应的发生。
③乙同学为了确定反应后所得溶液中溶质的成分,取少量溶液滴入几滴酚酞溶液,观察到溶液仍为无色。则烧杯内溶液中的溶质可能是①中的_______,为了继续探究烧杯内溶质的成分,乙同学认为可以选用铁、碳酸钠、氧化铜等多种试剂。请你分析该同学选用这些试剂的依据是什么?____________________
④区分无色溶液氢氧化钠和澄清石灰水的过程中,写出有明显现象发生的化学方程式。____________________
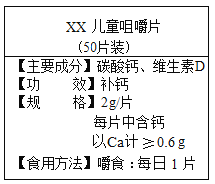
(3)如图某钙片可缓解胃酸过多症。若按用量服用,理论上每天可以消耗氯化氢的质量是多少? (保留一位小数)__________