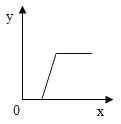题目内容
【题目】溶解度是解决溶液相关问题的重要依据。
I.根据溶解度曲线解决下列问题: (M,N均不含结晶水)
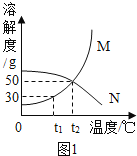
(1)t1℃时,将20g M加入50g水中,充分溶解,形成_________(填“饱和”或“不饱和”)溶液,溶液的质量为_____________g.保持温度不变,向该溶液中再加入10g水充分搅拌,溶液的溶质质量分数将_______(填“变大”、“变小”或“不变”) ;
(2)M物质中含有少量N物质,可用__________方法提纯M物质(填“降温结晶”或“蒸发结晶”) ;
(3)t2℃时,将25gN加入50g水中,完全溶解。若想提高该溶液的溶质质量分数,其操作方法是____________。
II.根据表格解决实际问题:
温度/°C | 20 | 30 | 50 | 80 | 90 | |
溶解度/g | KNO3 | 31.6 | 45.8 | 85.5 | 100 | 169 |
K2CO3 | 110 | 114 | 121 | 126 | 139 | |
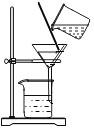
某KNO3样品中含有少量K2CO3,其提纯过程如图2(整个过程中水的质量没有变化):
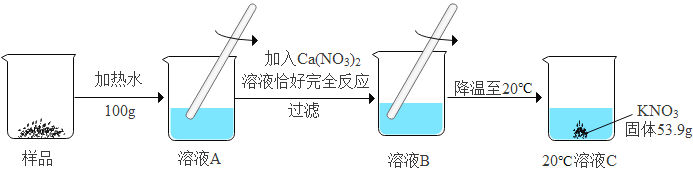
(1)图2中溶液C是__________(填“饱和”或“不饱和”)溶液; .
(2)样品中钾元素的质量为__________g (结果保留整数).
【答案】饱和 65 不变 降温结晶 降低温度,再加入N物质 饱和 33g
【解析】
I(1)t1℃时,M的溶解度是30g,根据溶解度概念可知,将20gM加入50g水中,充分溶解,只能溶解15g,形成饱和溶液,其溶液的质量为15g+50g=65g,保持温度不变,向该溶液中再加入10g水充分搅拌,10g水中能溶解3g,仍然是饱和溶液,溶液的溶质质量分数将不变;
(2)M的溶解度随温度降低而减小,N的溶解度随温度降低而增大,在较高温度配成饱和溶液,降温时,M析出,B不析出,M物质中含有少量N物质,可用降温结晶方法提纯M物质;
(3)t2℃时,N的溶解度是50g,将25gN加入50g水中,完全溶解形成的是饱和溶液,N的溶解度随温度降低而增大,要提高该溶液的溶质质量分数,可以降低温度,再加入N物质;
Ⅱ.(1)溶液C中有没有溶解的硝酸钾,是硝酸钾的饱和溶液;
(2)碳酸钾与硝酸钙反应生成硝酸钾和碳酸钙沉淀。50℃时硝酸钾的溶解度是85.5g,20℃时硝酸钾的溶解度是31.6g,析出晶体是53.9g,恰好是100g水中析出的硝酸钾的质量,故溶液C中水的质量是100g,其中硝酸钾的质量是31.6g,故硝酸钾的质量=53.9g+31.6g=85.5g,样品中钾元素的质量为![]() 。
。

 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案【题目】下列物质提纯所用的实验不正确的是
选项 | 物质(括号内为杂质) | 实验方法 |
A | CuO(Cu) | 在氧气流中充分加热 |
B | Fe(Al2O3) | 加入足量稀硫酸,充分反应后结晶 |
C | H2(HCl) | 通过装有NaOH 溶液的洗气瓶 |
D | KNO3 溶液(K2SO4) | 加入适量的 Ba(NO3)2 溶液,过滤 |
A.AB.BC.CD.D