题目内容
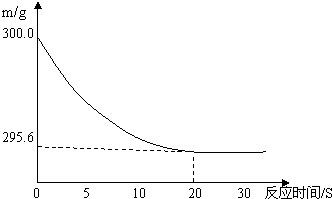
向盛有22.3 g Na2CO3和NaCl固体混合物的烧杯中加入216.1 g稀盐酸恰好反应,反应过程用精密仪器测得烧杯连同药品的质量(m)与反应时间(t)的关系如下图所示:烧杯连同药品的起始质量为300 g.回答下列问题:(1)当固体混合物与稀盐酸恰好完全反应时,所需时间约为______S.
(2)完全反应后,产生二氧化碳气体质量______g.
(3)反应后,得到室温下的不饱和溶液.所得溶液中溶质的质量分数为多少?
【答案】分析:(1)欲知当固体混合物与稀盐酸恰好完全反应时,所需时间,必须认识到,恰好反应后各物质的质量不再变化,再通过分析曲线图可知;
(2)曲线图所示的反应物质质量的减少,正是反应生成的气体挥发的结果;
(3)根据反应的化学方程式,得出各物质之间的比值关系,再由溶质的质量分数=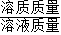 ×100%,先计算出所需数据,再进行计算.
×100%,先计算出所需数据,再进行计算.
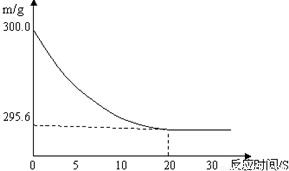
解答:解:(1)由反应曲线图可知,从20分钟时开始,曲线呈平直状态,说明反应已完全,故当固体混合物与稀盐酸恰好完全反应时,所需时间约为 20S;(1分)
(2)由图示可知,完全反应后,纵坐标表示的药品质量为295.6,而未反应前是300,减少的部分正是反应过程中生成的二氧化碳气体的质量,故完全反应后,产生二氧化碳气体质量为300g-295.6g=4.4g;(1分)
(3)解:设参加反应的碳酸钠的质量为x,反应生成的氯化钠的质量为y
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 117 44
x y 4.4g
∴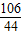 =
=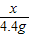 ,
,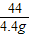 =
=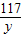 (1分)
(1分)
解之得:x=10.6g,y=11.7g;(1分)
又因为烧杯中不饱和溶液中溶液总质量为:
22.3 g Na2CO3和NaCl固体混合物的质量+216.1 g稀盐酸的质量-反应生成的二氧化碳的质量.
∴22.3g+216.1g-4.4g=234g;(1分)
溶液溶质(NaCl)的质量为11.7g+(22.3g-10.6g)=23.4g
所得不饱和溶液的溶质质量分数: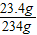 ×100%=10%.(1分)
×100%=10%.(1分)
答:所得溶液中溶质的质量分数为10%.
点评:本题主要测试学生对物质完全反应的认识,以及对溶质质量分数的计算能力,学生只有认真分析图示,掌握完全反应的特点,并能熟练计算,才能解答.
(2)曲线图所示的反应物质质量的减少,正是反应生成的气体挥发的结果;
(3)根据反应的化学方程式,得出各物质之间的比值关系,再由溶质的质量分数=
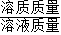 ×100%,先计算出所需数据,再进行计算.
×100%,先计算出所需数据,再进行计算.解答:解:(1)由反应曲线图可知,从20分钟时开始,曲线呈平直状态,说明反应已完全,故当固体混合物与稀盐酸恰好完全反应时,所需时间约为 20S;(1分)
(2)由图示可知,完全反应后,纵坐标表示的药品质量为295.6,而未反应前是300,减少的部分正是反应过程中生成的二氧化碳气体的质量,故完全反应后,产生二氧化碳气体质量为300g-295.6g=4.4g;(1分)
(3)解:设参加反应的碳酸钠的质量为x,反应生成的氯化钠的质量为y
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 117 44
x y 4.4g
∴
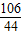 =
=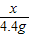 ,
,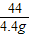 =
=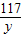 (1分)
(1分)解之得:x=10.6g,y=11.7g;(1分)
又因为烧杯中不饱和溶液中溶液总质量为:
22.3 g Na2CO3和NaCl固体混合物的质量+216.1 g稀盐酸的质量-反应生成的二氧化碳的质量.
∴22.3g+216.1g-4.4g=234g;(1分)
溶液溶质(NaCl)的质量为11.7g+(22.3g-10.6g)=23.4g
所得不饱和溶液的溶质质量分数:
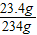 ×100%=10%.(1分)
×100%=10%.(1分)答:所得溶液中溶质的质量分数为10%.
点评:本题主要测试学生对物质完全反应的认识,以及对溶质质量分数的计算能力,学生只有认真分析图示,掌握完全反应的特点,并能熟练计算,才能解答.

练习册系列答案
相关题目
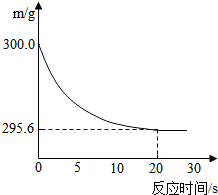 向盛有22.3 g Na2CO3和NaCl固体混合物的烧杯中加入216.1 g稀盐酸恰好反应,反应过程用精密仪器测得烧杯连同药品的质量(m)与反应时间(t)的关系如下图所示:烧杯连同药品的起始质量为300 g.回答下列问题:
向盛有22.3 g Na2CO3和NaCl固体混合物的烧杯中加入216.1 g稀盐酸恰好反应,反应过程用精密仪器测得烧杯连同药品的质量(m)与反应时间(t)的关系如下图所示:烧杯连同药品的起始质量为300 g.回答下列问题: