题目内容
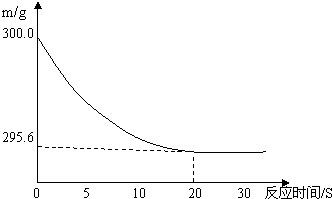
向盛有22.3 g Na2CO3和NaCl固体混合物的烧杯中加入216.1 g稀盐酸恰好反应,反应过程用精密仪器测得烧杯连同药品的质量(m)与反应时间(t)的关系如下图所示:烧杯连同药品的起始质量为300 g。
回答下列问题:
(1)当固体混合物与稀盐酸恰好完全反应时,所需时间约为 S。
![]() (2)完全反应后,产生二氧化碳气体质量 g。
(2)完全反应后,产生二氧化碳气体质量 g。
(3)反应后,得到室温下的不饱和溶液。所得溶液中溶质的质量分数为多少?

【解析】由图像变化趋势可知:从0~20秒,m逐渐减少,其原因必然是碳酸钠与盐酸反应产生二氧化碳气体跑出去了;从20秒开始,m不变了,即盐酸与碳酸钠反应结束了。故:二氧化碳的质量为300 g—295.6 g=4.4 g,然后据此代![]() 入化学方程式即可求出反应产生的碳酸钠。
入化学方程式即可求出反应产生的碳酸钠。
答案:(![]() 1)20; (2)4.4 g;
1)20; (2)4.4 g;
(3)解:设参加反应的碳酸钠的质量为x,反应生成的氯化钠的质量为y
Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O
106 117 44
x y 4.4
解得:x=10.6 g,y=11.7 g;
烧杯里不饱和溶液中溶质总质量为: 11.7 g + (22.3 g-10.6 g) = 23.4 g;
烧杯里不饱和溶液的质量为: 22.3 g+216.1 g-4.4 g = 234 g;
所得不饱和溶液的溶质质量分数:![]() ×100%=10%。
×100%=10%。
答:略。
【易错点点睛】此题与例1的难度和所考知识点相似,此题的易错点是溶液质量弄错,容易把295.6 ![]() g当作溶液的质量,另外容易忽视二氧化碳的质量。
g当作溶液的质量,另外容易忽视二氧化碳的质量。

练习册系列答案
相关题目
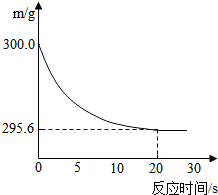 向盛有22.3 g Na2CO3和NaCl固体混合物的烧杯中加入216.1 g稀盐酸恰好反应,反应过程用精密仪器测得烧杯连同药品的质量(m)与反应时间(t)的关系如下图所示:烧杯连同药品的起始质量为300 g.回答下列问题:
向盛有22.3 g Na2CO3和NaCl固体混合物的烧杯中加入216.1 g稀盐酸恰好反应,反应过程用精密仪器测得烧杯连同药品的质量(m)与反应时间(t)的关系如下图所示:烧杯连同药品的起始质量为300 g.回答下列问题: