题目内容
向盛有22.3 g Na2CO3和NaCl固体混合物的烧杯中加入216.1g稀盐酸恰好反应,反应过程用精密仪器测得烧杯连同药品的质量(m)与反应时间(t)的关系如下图所示:烧杯连同药品的起始质量为300 g.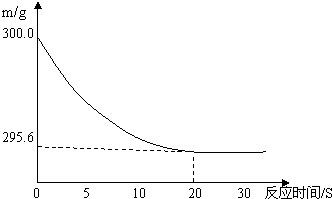
回答下列问题:
(1)当固体混合物与稀盐酸恰好完全反应时,所需时间约为
(2)完全反应后,产生二氧化碳气体质量
(3)反应后,得到室温下的不饱和溶液.所得溶液中溶质的质量分数为多少?
分析:(1)从反应物之间关系的曲线图可以看出,到20s时,反应曲线变成直线,说明反应物和生成物的质量不再变化,说明此时已是完全反应;
(2)从反应物之间关系的曲线图可以看出,完全反应后,烧杯连同药品的质量(m)为259.6g,比反应前减少的质量就是生成的气体的质量;
(3)根据化学方程式,得出各物质之间的质量比,列出比例式,即可计算出参与反应的碳酸钠的质量和反应生成的氯化钠的质量,然后根据反应生成的氯化钠的质量+混合物中氯化钠的质量=不饱和溶液中溶质质量,混合物质量+稀盐酸质量-生成气体质量=不饱和溶液的质量,再根据溶质质量分数公式计算即可.
(2)从反应物之间关系的曲线图可以看出,完全反应后,烧杯连同药品的质量(m)为259.6g,比反应前减少的质量就是生成的气体的质量;
(3)根据化学方程式,得出各物质之间的质量比,列出比例式,即可计算出参与反应的碳酸钠的质量和反应生成的氯化钠的质量,然后根据反应生成的氯化钠的质量+混合物中氯化钠的质量=不饱和溶液中溶质质量,混合物质量+稀盐酸质量-生成气体质量=不饱和溶液的质量,再根据溶质质量分数公式计算即可.
解答:解:(1)从反应物之间关系的曲线图可以看出,到20s时,反应曲线变成直线,说明反应物和生成物的质量不再变化,说明此时已是完全反应,故答案为:20.
(2)300g-259.6g=4.4g.故答案为:4.4.
(3)解:设参与反应的碳酸钠的质量为x,反应生成的氯化钠的质量为y,
Na2CO3+2HCl=2NaCl+CO2↑+H2O.
106 117 44
x y 4.4g
∴
=
,
=
解得:x=10.6g,y=11.7g,
烧杯里不饱和溶液中溶质总质量为:11.7g+(22.3g-10.6g)=23.4g,
烧杯里不饱和溶液的质量为:22.3g+216.1g-4.4g=234g,
所得不饱和溶液的溶质质量分数:
×100%=10%.
答:所得溶液中溶质的质量分数为10%.
(2)300g-259.6g=4.4g.故答案为:4.4.
(3)解:设参与反应的碳酸钠的质量为x,反应生成的氯化钠的质量为y,
Na2CO3+2HCl=2NaCl+CO2↑+H2O.
106 117 44
x y 4.4g
∴
| 106 |
| 44 |
| x |
| 4.4g |
| 117 |
| 44 |
| y |
| 4.4g |
解得:x=10.6g,y=11.7g,
烧杯里不饱和溶液中溶质总质量为:11.7g+(22.3g-10.6g)=23.4g,
烧杯里不饱和溶液的质量为:22.3g+216.1g-4.4g=234g,
所得不饱和溶液的溶质质量分数:
| 23.4g |
| 234g |
答:所得溶液中溶质的质量分数为10%.
点评:本题主要考查学生运用化学方程式和溶质质量分数公式进行计算的能力.

练习册系列答案
 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
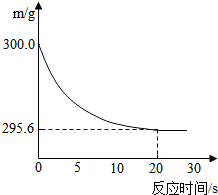 向盛有22.3 g Na2CO3和NaCl固体混合物的烧杯中加入216.1 g稀盐酸恰好反应,反应过程用精密仪器测得烧杯连同药品的质量(m)与反应时间(t)的关系如下图所示:烧杯连同药品的起始质量为300 g.回答下列问题:
向盛有22.3 g Na2CO3和NaCl固体混合物的烧杯中加入216.1 g稀盐酸恰好反应,反应过程用精密仪器测得烧杯连同药品的质量(m)与反应时间(t)的关系如下图所示:烧杯连同药品的起始质量为300 g.回答下列问题:

