题目内容
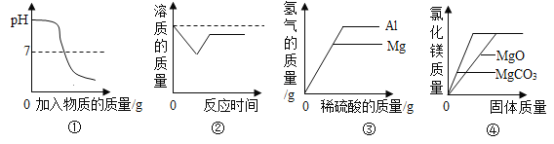
【题目】将氢氧化溶液加入稀硫酸的反应,溶液pH的变化如图所示。
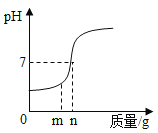
(1)当所加溶液的质量为mg时,所得溶液中溶质为______(写化学式)。
(2)完全中和一定质量的某硫酸溶液,需要100g 8%的氢氧化钠溶液,若改用100g 8%的氢氧化钾溶液,则反应后溶液的pH______7(填“>”、“<”或“=”)。
【答案】HCl和NaCl <
【解析】
解:(1)当所加溶液的质量为mg时,溶液的pH小于7,溶液显酸性,说明稀盐酸过量,所得溶液中的溶质为HCl和NaCl。
(2)完全中和一定质量的某硫酸溶液,需要100g 8%的氢氧化钠溶液,若改用100g 8%的氢氧化钾溶液,氢氧化钠与氢氧化钾溶液中所含溶质的质量相等。
由反应的化学方程式:H2SO4+2NaOH═Na2SO4+2H2O,H2SO4+2KOH═K2SO4+2H2O,等质量的硫酸与氢氧化钠和氢氧化钾反应,消耗的氢氧化钾质量多,则若改用100g8%的氢氧化钾溶液,稀硫酸有剩余,反应后溶液的pH<7。
故答案为:
(1)HCl和NaCl;(2)<。

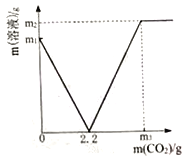
【题目】小明同学为了测定市面销售的某品牌纯碱中碳酸钠的质量分数(杂质为氯化钠,氯化钠溶于水且不与氯化钙反应),进行了如下实验:①在三个烧杯中分别加入11.0g 样品及足量的水配成溶液;②向三个烧杯中分别加入一定质量的10.0%的氯化钙溶液;③将充分反应后生成的沉淀过滤、洗涤、干燥,并称量得到的白色固体。实验所得数据见下表,请你分析并进行有关计算:
烧杯Ⅰ | 烧杯Ⅱ | 烧杯Ⅲ | |
加入10.0%氯化钙溶液的质量/g | 55.5 | 120.0 | 150.0 |
白色固体的质量/g | 5.0 | 10.0 | 10.0 |
(1)在图中绘制出白色沉淀与加入氯化钙溶液的质量关系图(图上要注明白色沉淀、氯化钙溶液的相关质量)。______
(2)样品中碳酸钠的质量分数是_____?(结果精确到0.1%)
(3)烧杯Ⅱ所得溶液中氯化钠的溶质质量分数是_______?(结果精确到0.1%)
【题目】甲、乙、丙三种物质的转化关系如右图所示(“→”表示反应一步实现,部分物质和反应条件已略去)。下列选项不能实现图示转化的是
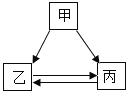
选项 | 甲 | 乙 | 丙 |
A | H2SO4 | H2 | H2O |
B | C | CO | CO2 |
C | Ca(OH)2 | CaCl2 | CaCO3 |
D | NaOH | NaCl | NaNO3 |
A. A B. B C. C D. D
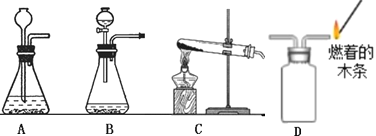
【题目】对下列实验指定容器中的水,其解释没有体现水的主要作用的是( )
A | B | C | D | |
实验装置 |
硫在氧气中燃烧 |
测定空气中氧气含量 |
铁丝在氧气中燃烧 |
排水法收集氢气 |
解释 | 集气瓶中的水:吸收放出的热 | 量简中的水:通过水体积的变化得出O2体积 | 集气瓶中的水:冷却溅落融熔物,防止集气瓶炸裂 | 集气瓶中的水:先将集气瓶内的空气排净,后便于观察H2何时收集满 |
A.AB.BC.CD.D