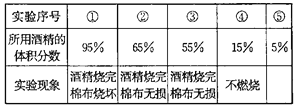
��Ŀ����
����Ŀ��С����СӢҪ��֤һ��ʯͷ�Ƿ�̼��ơ�
(1)С��˵����ֻҪȡһС��ʯͷ�����ձ��У�����ʯ���ϵ������ᣬ�����д������ݲ���������֤��ʯ�麬��̼��ơ���СӢ˵������ʯ���ϵ����ᣬ�����Ĵ�������������ӷ����ɵġ���СӢ��˵������_______������������������������
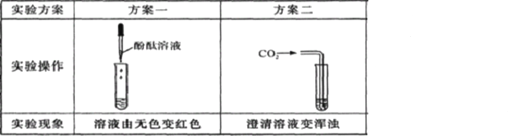
(2)С����СӢ���������������ʦ��������ʦ��ָ���£�����������ʵ��̽������ʵ��������£���ȡһС��ʯ�������ձ��У��μ�������ֲ�������ɫ��ζ���壻������ʦ��ָ���£�ȡ���е���Һ���飬ʯ���к��и�Ԫ�أ����������������ͼ��ʾ��ʵ��װ�ã���ʵ���й۲쵽���ƿ���л������������
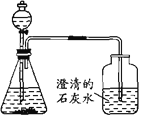
������ʵ���У����ǽ��е���_______ʵ���о���������������������������
(3)������ȡ10.0 gʯ����������ϡ���ᷴӦ�����ʲ������ᷴӦ�������ñ���ʯ��ˮ���գ��õ��ij������ʵ�������ø������7.5 g�����㣺
��ʯ���к�̼��Ƶ���������_______________��
����֪CO2�ڱ�״���µ��ܶ�Ϊ1.98 g/L�������ɱ�״����CO2��������Ϊ______________����?
���𰸡� ���� ���� 75%�� 1667 mL
�����������⿼���˸��ݻ�ѧ����ʽ�ļ��㣬���������ע�����ݵķ��������á�
��1������ӷ�ʱ�������������������������СӢ��˵�����ԣ�
��2��ͨ��ʵ����֤ʯͷ�Ƿ���̼���ʱ��û��ʹ�������о������ڶ���̽����
��3�����ݻ�ѧ����ʽ��CaCO3 + 2HCl == CaCl2 + H2O + CO2����CO2 + Ca(OH)2 == CaCO3 ��+ H2O�ɵã�CaCO3������������CO2����������������CaCO3
100 44 100
7.5g
ͨ���۲��֪����Ʒ��̼��Ƶ�����Ϊ7.5g
ʯ���к�̼��Ƶ���������Ϊ��![]() ��100%=75%��
��100%=75%��
�������ɶ�����̼����Ϊx
CaCO3+2HCl=CaCl2+H2O+CO2��
100 44
7.5g x
![]() =
=![]()
x=3.3g
������̼���Ϊ��3.3g��1.98g/L=1667 mL��