题目内容
【题目】钢铁厂购进含氧化铁(Fe2O3)85%的赤铁矿1000 t,准备用这些铁矿石炼取含杂质3%的生铁。
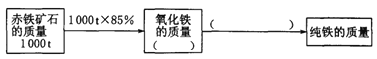
(1)如图所示,请将求算纯铁质量的计算过程填写完整。
(2)请利用化学方程式计算生铁的质量。(反应原理为3CO+Fe2O3![]() 2Fe+3CO2)(计算结果保留整数)
2Fe+3CO2)(计算结果保留整数)
【答案】(1)850 t (2)生铁的质量约为613 t
【解析】(1)、此题是利用铁元素在化学反应前后质量不变的原理解决,先用矿石乘以含氧化铁的质量分数求出氧化铁的质量,再利用化学式的计算出含有的铁元素的质量即是纯铁的质量;(2)、同理计算出氧化铁的质量利用这一反应物可求生成物纯铁的质量,再利用其除以3%可求出生铁的质量。
解:(1)、矿石中氧化铁的质量是:1000t×85%=850t,纯铁的质量是:1000t×85%×(![]() ×100%);
×100%);
(2)、由题意得,1000t赤铁矿中含氧化铁的质量是:1000t×85%=850t
设生成纯铁的质量为x
3CO+Fe2O3高温2Fe+3CO2
160 112
850t x
![]()
x=595t
生铁的质量是:595t÷(1-3%)=613t
答:生铁的质量为613t。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目