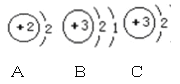题目内容
【题目】自然界里丰富多彩的物质都是由极其微小的粒子构成的,化学就像一架“显微镜”,带领我们一步步地深入认识和研究物质,使我们学会了“用微观眼光看世界”。
(1)海洋资源非常丰富。下图为海水中富含的钠元素和氯元素在元素周期表中的部分信息就,下列有关说法不正确的是___________。
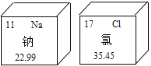
A 氯是一种非金属元素 B 钠元素的相对原子质量是22.99
C 钠原子的中子数为11 D 氯元素的原子序数为17
(2)如图是金属钠与氯气反应生成氯化钠的微观示意图,根据图示回答下列问题。
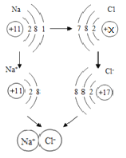
①钠原子的最外层电子数为____________;
②构成氯化钠的粒子是____________;
③由原子核外电子层数与元素所在周期表中的周期数相同可知,氯元素在周期表中应排在第_____周期。
④图中x=________,从得失电子的角度看,氯原子得到电子达到稳定结构后,其化合价将_____(填“升高”或“降低”)
(3)若“![]() ”表示一个甲烷分子(化学式CH4),则一个甲烷分子是由_____________甲烷中各元素的质量比为_____________。
”表示一个甲烷分子(化学式CH4),则一个甲烷分子是由_____________甲烷中各元素的质量比为_____________。
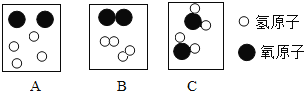
(4)下图是水分解过程中微粒变化的部分示意图,请按它们在化学变化过程中出现的顺序排列_______(用图中的字母表示)化学反应前后原子的数目____________(增多、减少、不变),C框中的物质属于_________________(填序号①化合物 ②单质 ③纯净物 ④混合物 ⑤氧化物),写出该反应的符号表达式___________。
【答案】C 1 钠离子和氯离子 三 17 降低 1个碳原子和4个氢原子构成 3:1 CAB 不变 氧化物 H2O ![]() H2+ O2
H2+ O2
【解析】
在元素周期表中,元素名称左上角的数字为原子的序数,右上角是该元素的符号。名称下边的数值是原子的相对原子质量。
(1) A 氯是一种非金属元素,选项正确;
B 钠元素的相对原子质量是22.99,选项正确;
C 钠原子的质子数为11 ,相对原子质量(整数)=质子数+中子数,中子数=23-11=12,选项错误;
D同一原子中,质子数=核外电子数=核电荷数=原子序数,氯元素的原子序数为17,选项正确;故选C;
(2) 在原子结构示意图中,小圆圈表示原子核,圆圈内的数字表示质子数,质子数决定原子的类别,弧线表示电子层,最外层电子数决定原子的化学性质。
①钠原子的最外层电子数为1;
②构成氯化钠的粒子是钠离子和氯离子;
③由原子核外电子层数与元素所在周期表中的周期数相同可知,氯元素在周期表中应排在第三周期;
④)在原子中核内质子数等于核外电子数,所以x=2+8+7=17,氯原子得到电子达到稳定结构后,质子数不变,电子数增加,所以形成的离子带负电,化合价降低;
(3)若“![]() ”表示一个甲烷分子(化学式CH4),则一个甲烷分子是由1个碳原子和4个氢原子构成,甲烷中碳、氢元素的质量比为12:4=3:1;
”表示一个甲烷分子(化学式CH4),则一个甲烷分子是由1个碳原子和4个氢原子构成,甲烷中碳、氢元素的质量比为12:4=3:1;
(4)化学反应的微观过程就是反应物的分子分成原子,原子再重新组合成新的分子,下图是水分解过程中微粒变化的部分示意图,请按它们在化学变化过程中出现的顺序排列CAB,化学反应前后原子的数目不变,C框中的物质是由两种元素组成的纯净物,且其中一种元素是氧元素,属于氧化物,电解水的符号表达式H2O ![]() H2+ O2。
H2+ O2。

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案