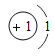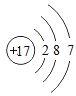题目内容
【题目】某碳酸钠样品含有少量的氯化钠,取12g该样品,加入60g水中使其完全溶解,再加入63.4g稀盐酸恰好完全反应,共产生气体4.4g.
(1)样品中碳酸钠的质量分数?(计算结果精确到0.1%)
(2)反应后所得溶液中溶质的质量分数是多少?
【答案】(1)88.3%;(2)10.0%
【解析】
碳酸钠样品能和盐酸发生的反应为碳酸钠和盐酸反应生成氯化钠和水以及二氧化碳,所以生成的气体为二氧化碳,即二氧化碳的质量为4.4g。题目需要求算碳酸钠的质量分数和反应后得到的溶液中溶质的质量分数也就是反应后的氯化钠溶液的NaCl的质量分数,所以碳酸钠和生成的氯化钠都要计算.还要考虑原混合物中的氯化钠的质量。
解:设样品中碳酸钠的质量为x。

![]()
x=10.6g
样品中碳酸钠的质量分数为![]() ×100%≈88.3%
×100%≈88.3%
答:(1)样品中碳酸钠的质量分数为88.3%;
(2)设生成的氯化钠的质量为y。

![]()
y=11.7g
反应后溶液中的氯化钠的质量为12g﹣10.6g+11.7g=13.1g
则所得溶液中氯化钠的质量分数为![]() ×100%=10.0%
×100%=10.0%
答:反应后所得溶液中溶质的质量分数是10.0%。

 智趣寒假作业云南科技出版社系列答案
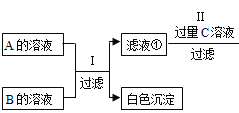
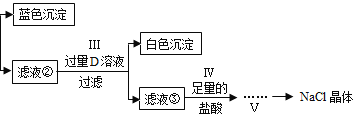
智趣寒假作业云南科技出版社系列答案【题目】化学课堂上,同学们在老师的指导下进行了分组实验。
(查阅资料)氯化钙溶液、氯化钠溶液都呈中性。
(1)第I组实验:探究酸和碱的反应。向试管中加入少量的氢氧化钙溶液,并滴入几滴无色酚酞溶液,充分振荡后,再逐滴滴入稀盐酸,并用玻璃棒不断搅拌,观察到溶液由红色变为无色,测得溶液的pH<7.该过程中发生反应的化学方程式为________,反应后溶液中的溶质为________。
(2)第Ⅱ组实验:为了探究一瓶忘记盖瓶塞的氢氧化钠溶液中溶质的成分,同学们进行了如下实验。
(提出猜想)
猜想1;溶质是氢氧化钠;
猜想2:溶质是________;
猜想3:溶质是碳酸钠。
(设计实验)
实验步骤 | 实验现象 | 实验结论 |
取少量样品于试管中,向其中加入适量的氯化钡溶液,充分反应后,过滤,向滤液中滴加几滴无色酚酞溶液 | ________ | 猜想3成立 发生反应的化学方程式为________。 |
(交流讨论)
老师问:“若向少量样品中,加入足量的稀盐酸,如果有气泡产生,猜想3一定成立吗?”同学们交流讨论后,一致认为猜想3不一定成立,原因是________。
(3)实验结束后,同学们将两组实验后的废液倒入同一个废液缸中进行集中处理。若使废液中只含有一种溶质氯化钠(酚酞除外)则需向废液中加入________。
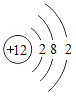
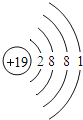
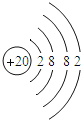
【题目】如表列出了部分人体中含量较多元素的原子结构示意图.请回答下列问题.
H | O | Na | Mg | Cl | K | Ca |
|
|
|
|
|
|
|
(1)属于第四周期的元素是_____.
(2)钙元素的核电荷数是_____,若某种该原子的相对原子质量为40,则它的中子数为_____.
(3)一般来说,金属元素的原子最外层电子数目_____(填“<”、“=”或“>”)4个;钠、钾的化学性质有许多相似之处,其原因是_____.
(4)比较下列三种微粒的架构,找出相同点和不同点.
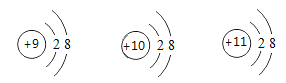
①相同点_____;(写出其中一点即可)
②不同点_____.(写出其中一点即可)