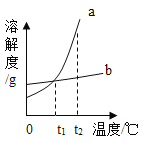
题目内容
【题目】高纯铊(Tl)及其合金可做半导体材料。现有5种含铊元素的物质:Tl、Tl2O、Tl2O3、TlOH、Tl2SO4。其中硫酸亚铊(Tl2SO4)溶液为无色,氢氧化亚铊(TlOH)溶液显黄色。请回答下列问题:
(1)Tl2O3读作_____。
(2)在加热条件下,氧化亚铊(Tl2O)与氢气反应生成铊和水,该反应的化学方程式为_____。
(3)取少量无色硫酸亚铊溶液于试管中,再滴加适量氢氧化钡溶液,充分振荡,静置,观察到的实验现象是______。
(4)已知Fe、Tl、Cu的金属活动性由强至弱的顺序为:Fe>Tl>(H)>Cu,以下说法正确的是____。
A 将金属Tl伸入稀硫酸中,金属表面有气泡冒出
B 将铜丝伸入Tl2SO4溶液中,铜丝表面附着一层固体
C 把锌伸入TlCl溶液中,可发生如下反应:Zn+2TlCl![]() 2Tl+ ZnCl2
2Tl+ ZnCl2
【答案】三氧化二铊 Tl2O+H2![]() 2Tl+H2O 溶液变黄,产生白色沉淀 AC
2Tl+H2O 溶液变黄,产生白色沉淀 AC
【解析】
(1)根据由两种元素组成的化合物的读法,读作“某化某”,还要读出原子的数目,所以Tl2O3读作三氧化二铊,故填三氧化二铊。
(2)在加热条件下,氧化亚铊(Tl2O)与氢气反应生成铊和水,故反应的化学方程式写为Tl2O+H2![]() 2Tl+H2O。
2Tl+H2O。
(3)硫酸亚铊溶液与氢氧化钡溶液反应生成氢氧化亚铊和硫酸钡白色沉淀,观察到的现象是溶液变黄,产生白色沉淀,故填溶液变黄,产生白色沉淀。
(4)A 由Fe、Tl、Cu的金属活动性由强至弱的顺序为Fe>Tl>(H)>Cu可知,金属Tl能与酸反应生成氢气,则将金属Tl伸入稀硫酸中,金属表面有气泡冒出,选项正确;
B 由Fe、Tl、Cu的金属活动性由强至弱的顺序为:Fe>Tl>(H)>Cu可知,将铜丝伸入Tl2SO4溶液中,铜丝表面没有附着一层其他固体,选项错误;
C 由Fe、Tl、Cu的金属活动性由强至弱的顺序为:Fe>Tl>(H)>Cu可知,锌的活动性强于铊,所以把锌伸入TlCl溶液中,可发生如下反应:Zn+2TlCl==2Tl+ ZnCl2,选项正确,故填AC。

 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
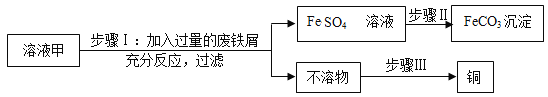
轻巧夺冠周测月考直通名校系列答案【题目】废铁屑主要成分是铁,还有少量铁锈(Fe2O3),硫酸亚铁的生产工艺如图所示。

(1)在反应器中除发生Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,Fe2(SO4)3+Fe═3FeSO4这两个反应外,还会发生另外一个反应,化学方程式为:_____,反应器要加强通风,严禁烟火,其原因是:_____。
(2)将成品在有氧条件下焙烧,可转化为Fe2O3、SO2和SO3.为了提高SO3的产率,某实验小组进行了系列探究,实验数据如下:
编号 | 空气通入量/Ls﹣1 | 温度/℃ | SO2产率% | SO3产率/% |
a | 0.02 | 850 | 45.4 | 54.6 |
b | 0.06 | 850 | 30.5 | 69.5 |
c | 0.10 | 810 | 11.1 | 88.9 |
d | 0.10 | 850 | 11.1 | 88.9 |
e | 0.10 | 890 | 11.2 | 88.8 |
①本实验主要研究了哪些因素对SO3产率的影响_____。
②根据上表数据,生产过程中采用实验_____(填编号)的提取条件最合理。