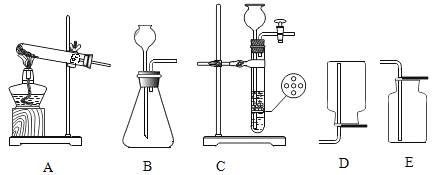
题目内容
【题目】利用A、 B两种盐可制得一系列重要化合物,A是BaC12且在I步反应中过量,B的溶液呈蓝色,有某制备过程如下图所示。已知C是一种碱。请回答下列问题:
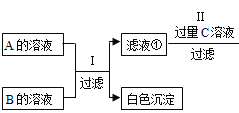
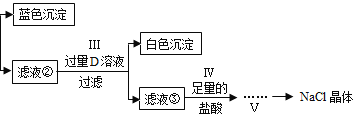
(1)你认为B物质是________。
(2)下列四种物质中,不符合C物质条件的是________。
①NaOH ②KOH ③Ca(OH)2 ④Ba(OH)2
(3)写出第Ⅳ步中发生反应的化学方程式________。
(4)在第V步中得到NaCl晶体一般采取的方法是________。
【答案】CuSO4 ② NaOH + HCl = NaCl + H2O ,Na2CO3 + 2HCl =2NaCl + H2O + CO2↑ 加热浓缩,蒸发结晶
【解析】
(1)B溶液呈蓝色,说明B中含有铜元素,而且B可以和A反应,生成白色沉淀,此白色沉淀可能为碳酸钡或者硫酸钡,由于碳酸铜不能稳定存在,所以B为硫酸铜;(2)滤液①加入C物质,生成蓝色沉淀,此沉淀应该为氢氧化铜;滤液②中加入过量D,生成白色沉淀,此沉淀可能为碳酸钡或碳酸钡与碳酸钙的混合物,所以C可能为氢氧化钠、氢氧化钡、氢氧化钙,但是不可能为氢氧化钾,因为加入氢氧化钾会引进钾离子不能被除去,最后得不到纯净的氯化钠晶体;D也不会是硫酸盐,因为引进硫酸根不能被除去,所以D是碳酸钠。
故选:②;
(3)在滤液③中,存在NaOH 和Na2CO3 ,加入稀盐酸,会发生中和反应和复分解反应,这两个化学方程式分别为氢氧化钠与稀盐酸反应产生氯化钠和水:NaOH + HCl = NaCl + H2O,碳酸钠与稀盐酸反应产生氯化钠、水和二氧化碳Na2CO3 + 2HCl =2NaCl + H2O + CO2↑;
(4)NaCl的溶解度随温度变化不大,所以可以蒸发溶剂,先使其饱和,然后再蒸发结晶,析出NaCl晶体。

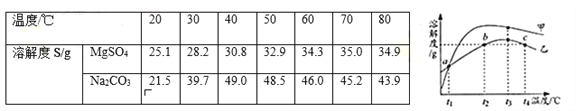
【题目】NH4Cl和Na2SO4的溶解度表及溶解度曲线如图.下列说法错误的是( )
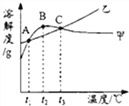
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度S/g | NH4Cl | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 60.2 |
Na2SO4 | 9.6 | 20.2 | 40.8 | 48.4 | 47.5 | 47.0 | |
A. 乙为NH4Cl
B. t3应介于40℃﹣50℃
C. 55℃时,分别将两饱和溶液蒸发等质量的水,得到固体质量甲>乙
D. 等质量的甲、乙饱和溶液从t3降温到t1,析出的晶体质量相等