题目内容
同学们从山上采集到一种石灰石,他们取80克该样品进行煅烧实验(所含杂质在煅烧过程中不发生变化),测得反应后固体的质量(m)与反应时间(t)的关系如下表:
请回答下列问题:
(1)当石灰石完全反应后,生成CO2的质量为 g。
(2)求该石灰石中CaCO3的质量分数,写出计算过程。
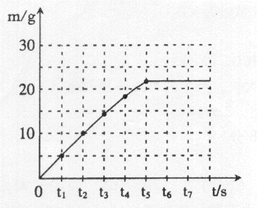
(3)请在下面坐标图中,画出煅烧时生成气体的质量(m)随时间(t)变化的曲线。
| 反应时间t∕s | t0 | t1 | t2 | t3 | t4 | t5 | t6 |
| 反应后固体的质量m∕g | 80 | 75 | 70 | 66 | 62 | 58 | 58 |
(1)当石灰石完全反应后,生成CO2的质量为 g。
(2)求该石灰石中CaCO3的质量分数,写出计算过程。
(3)请在下面坐标图中,画出煅烧时生成气体的质量(m)随时间(t)变化的曲线。

(1)22g
(2)解:设样品中含CaCO3的质量为x

CaCO3 CaO + CO2↑
100 44
x 22g
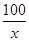 =
=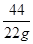 x =
x =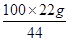 =50g
=50g
石灰石中CaCO3的质量分数=(50g÷80g)×100%=62.5%
(3)
(2)解:设样品中含CaCO3的质量为x

CaCO3 CaO + CO2↑
100 44
x 22g
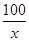 =
=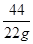 x =
x =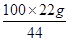 =50g
=50g 石灰石中CaCO3的质量分数=(50g÷80g)×100%=62.5%
(3)

本题考查的是根据化学反应方程式的计算,质量守恒定律及其应用。由于碳酸钙高温下分解放出气体二氧化碳而使反应后剩余固体的质量减小,因此,当反应至固体质量不再减小时,即碳酸钙完全分解。根据质量守恒定律,所减少的质量即为放出二氧化碳气体的质量,根据反应的化学方程式,由放出二氧化碳气体的质量可计算出样品中碳酸钙的质量,最后利用所求碳酸钙的质量/石灰厂样品的质量80g ×100%计算石灰石样品中碳酸钙的质量分数。最后根据表格绘图即可。

练习册系列答案
相关题目