题目内容
【10乌鲁木齐市18】.(5分)右图是某试剂瓶标签上的内容。

(1)把这种浓硫酸稀释为19.6%的硫酸溶液200g,需要这种硫酸的质量为 g。
(2)稀释浓硫酸时,应注意的事项为 。
(3)用稀释后的硫酸溶液与13g锌完全反应,可生成氢气多少克?

(1)把这种浓硫酸稀释为19.6%的硫酸溶液200g,需要这种硫酸的质量为 g。
(2)稀释浓硫酸时,应注意的事项为 。
(3)用稀释后的硫酸溶液与13g锌完全反应,可生成氢气多少克?
(共5分)
(1)40g
(2)把浓硫酸沿着容器内壁慢慢注入水中,并且玻璃不断搅拌。
(3)解:设可生成氢气的质量为x
Zn+H2SO4=ZnSO4+H2↑
65 2
13g x
65:2=13g:x
x=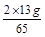 =0.4g
=0.4g
(1)40g
(2)把浓硫酸沿着容器内壁慢慢注入水中,并且玻璃不断搅拌。
(3)解:设可生成氢气的质量为x
Zn+H2SO4=ZnSO4+H2↑
65 2
13g x
65:2=13g:x
x=
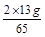 =0.4g
=0.4g本题考查的是根据化学反应方程式的计算,浓硫酸的性质及浓硫酸的稀释,有关溶质质量分数的简单计算。
(1)溶液加水稀释前后溶质的质量不变,根据稀释后所得溶液的质量可计算所需稀释前的浓溶液的质量;设需要98%的硫酸的质量为x
200g×19.6%=x×98% x=40g
(2)浓硫酸加水稀释时,为防止因硫酸溶解放出大量的热使水爆沸而溅出,一定要把浓硫酸沿容器内壁慢慢注入水中,并不断搅拌,切不可把水倒入硫酸中;
(3)设可生成氢气的质量为y
Zn+H2SO4=ZnSO4+H2↑
65 2
13g y
65/13g =2/y
y="2×13g/65" =0.4g
答:13g锌完全反应,可生成氢气0.4g.
(1)溶液加水稀释前后溶质的质量不变,根据稀释后所得溶液的质量可计算所需稀释前的浓溶液的质量;设需要98%的硫酸的质量为x
200g×19.6%=x×98% x=40g
(2)浓硫酸加水稀释时,为防止因硫酸溶解放出大量的热使水爆沸而溅出,一定要把浓硫酸沿容器内壁慢慢注入水中,并不断搅拌,切不可把水倒入硫酸中;
(3)设可生成氢气的质量为y
Zn+H2SO4=ZnSO4+H2↑
65 2
13g y
65/13g =2/y
y="2×13g/65" =0.4g
答:13g锌完全反应,可生成氢气0.4g.

练习册系列答案
相关题目


 CaO+CO2↑若生产含氧化钙25.2t的生石灰,则至少需要含碳酸钙90%的石灰石多少吨?
CaO+CO2↑若生产含氧化钙25.2t的生石灰,则至少需要含碳酸钙90%的石灰石多少吨?
 (1)在人体中,碘是属于 ▲ (选填“常量”或“微量”)元素。
(1)在人体中,碘是属于 ▲ (选填“常量”或“微量”)元素。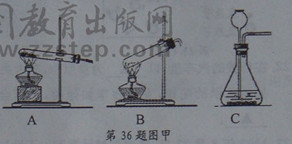
 :
: