题目内容
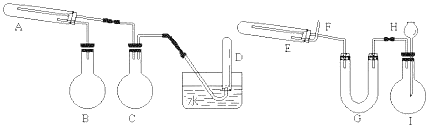
【题目】氯化钠是重要的化工原料,氯碱工业生产的一种流程如图:

(1)从“海水→粗盐→精盐”的过程包括溶解、过滤、蒸发等实验操作,实验室中上述3种操作都需要使用的仪器是__(填名称)。
(2)“食盐水”中常含有NaCl、MgCl2、CaCl2等物质,“精制”过程中加入NaOH的目的是__。
(3)写出“电解槽“中发生反应的化学方程式__,流程中可以循环使用的物质有__(填化学式)。
(4)氯碱工业生产的碱样品中常含有Na2CO3和NaCl等杂质,用“离子交换膜法”生产的碱样品质量主要标准如下表所示
等级 | 氢氧化钠含量 | 碳酸钠含量 |
优等品 | ≥99.0% | ≤0.5% |
一等品 | ≥98.5% | ≤0.8% |
合格品 | ≥98.0% | ≤1.0% |
①你认为碱样品中含有Na2CO3的原因是__,检验碱样品中是否含有Na2CO3,下列试剂中可选择使用的是__。
a.酚酞 b.稀盐酸c。澄清石灰水
②李老师设计和完成了如下实验来判断碱样品的等级。
称取20.3g碱样品,加足量水溶解,再加入足量的氯化钡溶液,充分反应后,过滤得到滤渣和滤液;将滤渣洗涤,干燥得到碳酸钡(BaCO3)固体0.197g;向滤液中加入几滴酚酞,再逐滴加入稀盐酸至恰好完全反应,共消耗溶质质量分数为5%的稀盐酸365g。该碱样品的等级是__(不考虑其他杂质参加反应)。
【答案】玻璃棒除去氯化钠中的杂质氯化镁2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑;NaOH部分氢氧化钠与二氧化碳反应生成了碳酸钠;bc一等品
2NaOH+Cl2↑+H2↑;NaOH部分氢氧化钠与二氧化碳反应生成了碳酸钠;bc一等品
【解析】
(1)溶解、过滤、蒸发等实验操作中都需要使用的仪器是玻璃棒;
(2)“精制”过程中加入NaOH可以与氯化镁反应生成氢氧化镁沉淀,可以除去氯化镁;
(3)“电解槽“中氯化钠化钠和水通电分解生成氢氧化钠、氯气和氢气,发生反应的化学方程式为2NaCl+2H2O通电2NaOH+Cl2↑+H2↑,流程中可以循环使用的物质是NaOH;
(4)①碱样品中含有Na2CO3的原因是因为氢氧化钠与二氧化碳反应生成碳酸钠,检验碱样品中是否含有Na2CO3,a.酚酞不能选,因为氢氧化钠和碳酸钠都是呈碱性的;b.稀盐酸能与碳酸钠反应产生气体,可以选用;c.澄清石灰水能与碳酸钠反应产生白色沉淀,可以选用,故选bc;
②由于碱样品中含碳酸钠、氯化钠,故根据碳酸钡计算碳酸钠的质量计算的结果不如计算氢氧化钠的质量准确,设氢氧化钠的质量为x
HCl+ NaOH═NaCl+H2O
36.5 40
365g×5% x
![]()
x=20g
氢氧化钠的质量分数为:![]() ≈98.5%
≈98.5%
该碱样品的等级是是一等品。

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案