题目内容
【题目】利用如图所示装置进行如下实验探究。
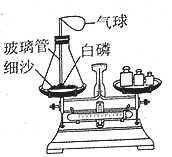
在锥形瓶中放入一小粒白磷,塞好瓶塞后玻璃管下端刚好能与白磷接触,将整套装置放在托盘天平上调节至平衡,取下橡皮塞,将玻璃管放在酒精灯火焰上灼烧至红热,迅速塞紧瓶塞,将白磷引燃,待锥形瓶冷却后观察天平是否平衡。
(1)实验时,气球的变化是__。
(2)根据白磷引燃前后的变化,可知燃烧的条件是__;玻璃管受热不燃烧,白磷受热能燃烧,可知燃烧的条件是__。
(3)实验前后天平保持平衡,实验后,松开橡皮塞,则天平指针__(填“向左偏”“向右偏”或“指向中间”)
(4)白磷(P4)燃烧生成P2O5,写出该反应的化学方程式:__。
【答案】变小达到着火点;物质是可燃物向左偏P4+5O2![]() 2P2O5
2P2O5
【解析】
(1)实验时,白磷燃烧放热,导致瓶内气压增大,气球膨胀,冷却至室温后,瓶内氧气消耗,气压减小,气球收缩,因此气球的变化是先膨胀后缩小。
(2)根据白磷引燃前后的变化,可知燃烧的条件是与氧气接触,温度达到可燃物着火点;玻璃管受热不燃烧,白磷受热能燃烧,可知燃烧的条件是可燃物。
(3)实验前后天平保持平衡,实验后,松开橡皮塞,空气进入瓶中,则天平指针向左偏。
(4)白磷燃烧生成P2O5,该反应的化学方程式为:P4+5O2![]() 2P2O5。
2P2O5。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
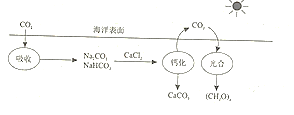
期末集结号系列答案【题目】氯化钠是重要的化工原料,氯碱工业生产的一种流程如图:

(1)从“海水→粗盐→精盐”的过程包括溶解、过滤、蒸发等实验操作,实验室中上述3种操作都需要使用的仪器是__(填名称)。
(2)“食盐水”中常含有NaCl、MgCl2、CaCl2等物质,“精制”过程中加入NaOH的目的是__。
(3)写出“电解槽“中发生反应的化学方程式__,流程中可以循环使用的物质有__(填化学式)。
(4)氯碱工业生产的碱样品中常含有Na2CO3和NaCl等杂质,用“离子交换膜法”生产的碱样品质量主要标准如下表所示
等级 | 氢氧化钠含量 | 碳酸钠含量 |
优等品 | ≥99.0% | ≤0.5% |
一等品 | ≥98.5% | ≤0.8% |
合格品 | ≥98.0% | ≤1.0% |
①你认为碱样品中含有Na2CO3的原因是__,检验碱样品中是否含有Na2CO3,下列试剂中可选择使用的是__。
a.酚酞 b.稀盐酸c。澄清石灰水
②李老师设计和完成了如下实验来判断碱样品的等级。
称取20.3g碱样品,加足量水溶解,再加入足量的氯化钡溶液,充分反应后,过滤得到滤渣和滤液;将滤渣洗涤,干燥得到碳酸钡(BaCO3)固体0.197g;向滤液中加入几滴酚酞,再逐滴加入稀盐酸至恰好完全反应,共消耗溶质质量分数为5%的稀盐酸365g。该碱样品的等级是__(不考虑其他杂质参加反应)。
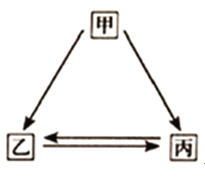
【题目】甲、乙、丙三种物质的转化关系如图所示(“→”表示反应一步实现,部分物质和反应条件 已略去).下列选项不能实现图示转化的是
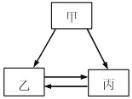
选项 | 甲 | 乙 | 丙 |
A | H2SO4 | H2 | H2O |
B | C | CO | CO2 |
C | NaOH | NaCl | NaNO3 |
D | Ca(OH)2 | CaCl2 | CaCO3 |
A. A B. B C. C D. D
【题目】学习了金属的有关知识后,同学们知道了如何鉴别黄金和黄铜(铜锌合金,俗名“愚人金”)。某化学兴趣小组的同学为了进一步测定某黄铜的组成,称取了黄铜样品50g放入锥形瓶中,向其中分5次共加入250g稀硫酸,测得数据记录如下表。
次数 质量 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
累计加入稀硫酸的质量/g | 50 | 100 | 150 | 200 | 250 |
累计产生气体的质量/g | 0.2 | x | 0.6 | 0.7 | 0.7 |
回答下列问题:
(1)x=__,该样品中铜的质量为__g。
(2)请在如图中画出样品中加入250g稀硫酸,产生气体的质量与稀硫酸的质量变化关系示意图。

(3)黄铜样品与稀硫酸恰好完全反应时,所得溶液的溶质的质量分数是_____?(精确到0.01)