题目内容
【题目】某校化学兴趣小组同学用一瓶含有杂质氯化钠的硫酸钠固体样品,进行如图所示的实验.
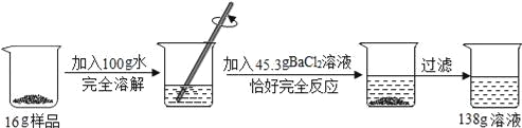
请根据以上信息计算:
(1)该实验中生成沉淀的质量。
(2)反应后所的溶液中溶质的质量分数(精确到0.1%)。
【答案】(1)23.3g;(2)9.8%
【解析】根据质量守恒定律,(1)该实验中生成沉淀的质量∶16g+100g+45.3g-138g=23.3g. (2)解∶设反应后生成氯化钠质量为xg,样品中硫酸钠质量为yg
Na2SO4 +BaCl2 =Ba SO4↓+2NaCl
142 233 117
Y 23.3g x
![]() =
=![]() ,x=11.7g,
,x=11.7g, ![]() =
=![]() ,y=14.2g.
,y=14.2g.
反应后所的溶液中溶质的质量分数∶![]() ×100%=9.8%.
×100%=9.8%.
答∶(1)该实验中生成沉淀的质量是23.3g. (2)反应后所的溶液中溶质的质量分数是9.8%.
点睛∶本题主要考查质量守恒定律的应用以及根据化学方程式进行计算。

练习册系列答案
相关题目
【题目】a、b可发生化合反应生成c。小辰做了两次该实验(每次均充分反应),反应前a、b的质量总和都是9g,实验数据如下表。则m : n的值为
序号 | 反应前a的质量/g | 反应前b的质量/g | 反应后c的质量/g |
① | 7 | 2 | 6 |
② | m | n | 9 |
A. 5:4 B. 2:7 C. 2:1 D. 1:8