题目内容
【题目】硝酸(HNO3)是高中化学将要学习的一种常见物质,回答下列问题:
(1)硝酸中氮元素的化合价为______价,浓硝酸见光会发生分解反应,生成红棕色的NO2气体和一种常见液体以及能供给呼吸的气体,写出该反应的化学方程式______________________。
(2)Na2SO4、Ba(OH)2、H2SO4、HNO3四种无色溶液如不加其他试剂,无法鉴别出的溶液是_________,若要将它们鉴别出来,可以选用的试剂是___________。
【答案】+5 4HNO3![]() 4NO2↑+2H2O+O2↑ Na2SO4、H2SO4 紫色的石蕊试液(合理答案均可)
4NO2↑+2H2O+O2↑ Na2SO4、H2SO4 紫色的石蕊试液(合理答案均可)
【解析】
(1)设硝酸中氮元素的化合价为x,根据化合物中各元素代数和为零,则+1+x+(-2×3)=0,x=+5,硝酸中氮元素的化合价为+5价,浓硝酸见光会发生分解反应,生成红棕色的二氧化氮气体和一种常见液体以及能供给呼吸的气体,根据质量守恒定律,可知,浓硝酸在光照条件下反应生成二氧化氮、水和氧气,该反应的化学方程式为![]() 。
。
(2)四种溶液相互滴加,其中有两次沉淀生成的是氢氧化钡,无任何现象的是硝酸,只有一次沉淀生成的是硫酸钠、硫酸,因为硫酸钠呈中性,硫酸显酸性,故若要将它们鉴别出来,可以选用的试剂是紫色的石蕊试液,无颜色变化的是硫酸钠,变红色的是硫酸。

【题目】为分析由氧化铜和铜组成的混合物中氧化铜的质量分数,现取3份该混合物各20 g,分别缓慢加入到50 g、100 g、150 g某稀硫酸中,测得三组实验数据如表:
组别 | 第Ⅰ组 | 第Ⅱ组 | 第Ⅲ组 |
稀硫酸的质量/g | 50 | 100 | 150 |
剩余固体的质量/g | 10.0 | 4.0 | 4.0 |
根据实验及有关数据进行分析与计算:
(1)第Ⅰ组实验中反应物_____________(填“氧化铜”“稀硫酸”或“氧化铜与稀硫酸”)反应完。
(2)20 g样品中含氧化铜的质量为____________g。
(3)根据第Ⅰ组数据计算所用的稀硫酸溶质的质量分数____________(写出计算过程)。
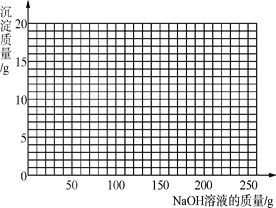
(4)将第Ⅱ组混合物过滤,在滤液中滴加10%的NaOH溶液,画出在该混合溶液中加入10% NaOH溶液的质量与生成沉淀质量变化关系的曲线图___________。