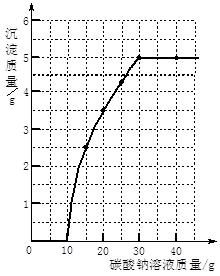题目内容
(6分)有NaOH和Na2CO3的混合物9.3g,为测定其中NaOH的质量,将混合物溶于一定量的水中后,再向其中加入200g稀硫酸时恰好使Na2CO3完全转化为CO2,产生的CO2气体共2.2g。
(1)求混合物中NaOH的质量是多少?
(2)若要求出反应后溶液中硫酸钠的质量分数,题中还缺少一个原始数据m(单位为:g),请问m表示什么?
(3)请用含m的代数式表示反应后溶液中硫酸钠的质量分数。
(1)4g (2) m表示9.3g混合物溶于水时,所用水的质量
(3) [14.2/(207.1+m)]×100%
解析试题分析:(1)根据反应:Na2CO3+H2SO4==Na2SO4+H2O+CO2↑中Na2CO3与CO2的质量关系,即可求出Na2CO3 的质量,进而可算出NaOH的质量,若要求出反应后溶液中硫酸钠的质量分数,则必须要算出反应后溶液的总质量,所以题中还缺少一个原始数据m,(2)m表示m表示9.3g混合物溶于水时,所用水的质量,要计算硫酸钠的质量分数,则需要求算出生成硫酸钠的质量
解:设Na2CO3 的质量为x,生成硫酸钠的质量为y
Na2CO3+H2SO4==Na2SO4+H2O+CO2↑
106 142 44
x y 2.2g
106:44=x:2.2g x=5.3g
所以NaOH的质量=9.3g-5.3g=4g
142:44=y:2.2g y=7.1g
设另一个反应生成硫酸钠的质量为z
2NaOH+H2SO4==Na2SO4+2H2O
80 142
4g z
80:142=4g:z z=7.1g
而反应后溶液的总质量=9.3g+200g+m-2.2g=207.1g+m
所以反应后溶液中硫酸钠的质量分数= [14.2/(207.1+m)]×100%
考点:根据化学方程式计算

在一个密闭容器内有如下反应,反应前后测得各物质的质量如下表所示:
| 物质 | M | N | P | Q |
| 反应前的质量/g | 40 | 4 | 3.6 | 4.8 |
| 反应后的质量/g | 待测[ | 13 | 12.6 | 10.8 |
A.该反应为化合反应 B.反应生成的P和Q的质量比为2︰3
C.待测值为16 D.N和P的相对分子质量之比为1︰1
小英同学为了测定某地区石灰石样品中碳酸钙的质量分数,取该样品15g,现将75mL的稀盐酸分三次加入石灰石样品中,每次充分反应后测得生成气体的质量,实验数据如下表:
| 实验 | 第一次 | 第二次 | 第三次 |
| 加入稀盐酸的量/mL | 25 | 25 | 25 |
| 生成气体的质量/g | 2.2 | m | 1.1 |
(1)m的值是 g.
(2)求该样品中碳酸钙的质量分数(保留一位小数).
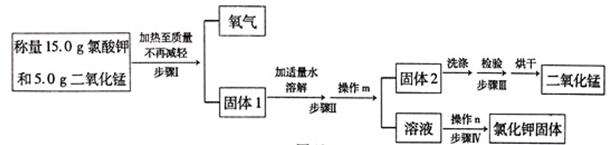
 2KCl+3O2↑),并回收提纯氯化钾和二氧化锰。
2KCl+3O2↑),并回收提纯氯化钾和二氧化锰。