题目内容
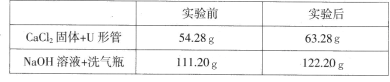
在一个密闭容器内有如下反应,反应前后测得各物质的质量如下表所示:
| 物质 | M | N | P | Q |
| 反应前的质量/g | 40 | 4 | 3.6 | 4.8 |
| 反应后的质量/g | 待测[ | 13 | 12.6 | 10.8 |
A.该反应为化合反应 B.反应生成的P和Q的质量比为2︰3
C.待测值为16 D.N和P的相对分子质量之比为1︰1
C
解析试题分析:由表中数据及质量守恒定律可知,待测数据为:16;该反应的反应物为M,参加反应的质量为24g,生成物为N、P、Q,生成的质量依次为9g、9g、6g;故A.该反应为分解反应 ,选项错误; B.反应生成的P和Q的质量比为9:6=3︰2,选项错误;C.待测值为16,选项正确;D.因为无法确定参加反应的N和P分子个数比,故无法确二者的相对分子质量之比,选项错误
考点: 质量守恒定律;化学方程式的意义

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
如图是某化学反应的微观模型,“ ”、“
”、“ ”分别表示不同元素的原子,下列各项中对图示模型理解正确的是( )
”分别表示不同元素的原子,下列各项中对图示模型理解正确的是( )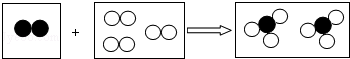
| A.该反应属于分解反应 |
| B.反应物和生成物中只有一种单质 |
| C.反应中共有两种元素参与 |
| D.参加反应的两种物质分子个数之比为2:3 |
氧化亚铜(Cu2O)是鲜红色粉末状固体,可用作杀菌剂、陶瓷和搪瓷的着色剂、红色玻璃染色剂等。现将 Cu2O 和 Cu 的固体混合物 6.8g 放入烧杯中,加入足量的稀硫酸,充分反应后,过滤、洗涤、干燥,得到 4.8g 固体。(已知Cu2O+H2SO4=CuSO4+Cu+H2O)。则原混合物中的 Cu2O 和 Cu 质量比为
| A.9∶8 | B.17∶12 | C.1∶1 | D.9∶4 |
下列四个坐标示意图分别表示四个实验过程中的某些变化情况,其中肯定错误的是 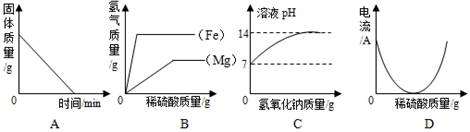
| A.加热一定量碳铵(NH4HCO3)的实验,试管中固体的质量变化 |
| B.等质量的镁条和铁丝分别与足量的稀硫酸反应,产生气体的质量变化 |
| C.向一定质量的水中加入氢氧化钠时,形成的溶液pH的变化 |
| D.向盛有一定量Ba(OH)2溶液的烧杯中逐滴滴加稀硫酸,测得烧杯中溶液导电性的变化 |
一氧化碳和二氧化碳的混合物10克,通过足量的炽热的氧化铜,充分反应后所得气体的质量为11.6克,则原混合物中二氧化碳的质量为 ( )
| A.5.6克 | B.4.4克 | C.7.2克 | D.2.8克 |