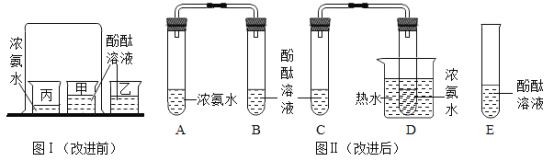
��Ŀ����
����Ŀ����������Һ��֪ʶ�ش��������⣮
(1)�����£���һ����������ع������ܽ���ˮ�У���Һ�ﵽ���ͺ�����δ�ܹ��壮���Ⱥ�δ�ܵ�����ع���ȫ���ܽ⣬˵�����ʵ��ܽ�����_____�йأ�
��������ˮ�������ھƾ���˵�����ʵ��ܽ��Ի���_____�йأ�
(2)��ͼ��40��ʱ�Ȼ�淋��ܽ�����ߣ�
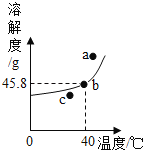
���Ȼ�����ڻ�ѧ�����е�_____(�����)��
A���ط� B������ C����
�ڸ�ͼ��a��b��c�����ܱ�ʾ�Ȼ����Һ���ڲ�����״̬����_____��
�ڲ������Ȼ����Һ��Ϊ������Һ�Ĺ����У�����������ȷ����_____��
A�����ʵ�����һ����С B���ܼ�������һ����С
C����Һ������һ����� D�����������������ܲ���
�������£���һƿ�Ȼ����Һ���ڷ���һ��ʱ�䣬��������������10%���25%������ǰ���ܼ���������_____��
���𰸡��¶� �ܼ����� B c D 3��1
��������
�����ܽ�����ߵ����壺���ܽ�������ϵĵ㼰�����Ϸ��ĵ��ʾ�Ķ���ij�¶��µı�����Һ���������·��ĵ��ʾ�Ķ��Dz�������Һ�ȡ�
(1)���ڸ��������Һ����ʱ��δ�ܽ������ع����ȫ���ܽ⣬˵�����ʵ��ܽ������¶��йأ���������ˮ�������ھƾ���˵�����ʵ��ܽ��Ի����ܼ��������й���
(2)���Ȼ�狀���Ӫ��Ԫ�ص�Ԫ�أ�������ڵ�����
���������ܽ�������ϵĵ㼰�����Ϸ��ĵ��ʾ�Ķ���ij�¶��µı�����Һ���������·��ĵ��ʾ�Ķ��Dz�������Һ����Ҫʹ�Ȼ���һƿ�Ȼ����Һ���ڷ���һ��ʱ��淋IJ�������Һ��Ϊ������Һ���ɲ�ȡ�������ʡ������ܼ����µķ�����
������ʱ����һƿ�Ȼ����Һ���ڷ���һ��ʱ�䣬����ˮ�ֵ����������ʵ�����������������ˮ�������Ĺ��������ʵ��������䣬����ԭ��Һ�����ʵ�����Ϊag�����ԭ��Һ������Ϊ![]() =10ag������Һ������Ϊ
=10ag������Һ������Ϊ![]() =4ag����˷���ǰ���ܼ���������Ϊ(10a��a)��(4a��a)=3��1��
=4ag����˷���ǰ���ܼ���������Ϊ(10a��a)��(4a��a)=3��1��

 ѧ���쳵�����ּ��ں�����ҵϵ�д�
ѧ���쳵�����ּ��ں�����ҵϵ�д�����Ŀ����һ�������Ҵ�����������һ����ȫ��յ���������ȼ����Ӧ���ɶ�����̼��ˮ������һ��δ֪��X����÷�Ӧǰ�����ʵ��������±���
���� | �Ҵ� | ���� | ������̼ | ˮ | X |
��Ӧǰ����/g | 4.6 | 8 | 0 | 0 | 0 |
��Ӧ������/g | 0 | 0 | 4.4 | 5.4 | m |
�����ж���ȷ����(����)
A. ����m��ֵ��ȷ��
B. X�����Ǹ÷�Ӧ�Ĵ���
C. ���������������Լ���X������
D. ����Xһ������̼Ԫ�أ����ܺ�����Ԫ��
����Ŀ���ᡢ�����������Ҫ���ʣ�
(1)ʵ��������һƿ���ڷ��õ�Ũ���ᣮ�������������ͷ��������Ĺ�ϵ��ͼ������ˮ������������Ũ������������������仯��ԭ��_____��
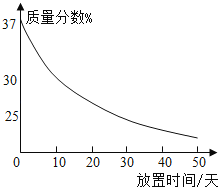
(2)�۲�ͼƬ����С�Թ��ڵμ�ˮ�����������ƹ����ܽ��⣬���ɹ۲쵽��������_____�����Ͳ����������ԭ��_____��_____��
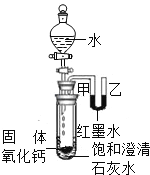
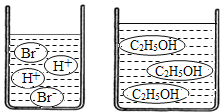
(3)��ͼ�ֱ����廯��(HBr)���Ҵ�(C2H5OH)��ˮ�е���ʾ��ͼ�����������е��ᡢ��֪ʶ���ж��廯���ˮ��Һ��_____���Ҵ���ˮ��Һ��_____(������������������������������)��
(4)��ʢ��10mLϡ����(���е�������ָʾ��)���ձ��м�������������Һ����pH�Ʋⶨ��Һ��pH�������������£���������ش��������⣺
����NaOH��Һ�����/mL | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 |
�ձ�����Һ��pH | 1.1 | 1.2 | 1.4 | 1.6 | 2.5 | 7.0 | 11.0 | 12.0 |
�����μӵ�ָʾ������ɫʯ����Һ������������������Һ�����Ϊ13mLʱ����Һ��_____ɫ��
�����μ�ָʾ������ɫ��̪��Һ��������������Һ�������Һ��ɫ�ޱ仯����ʱ��Һ�е�����һ����(�ѧʽ)_____��������_____��