题目内容
【题目】酸、碱、盐是三类重要物质.
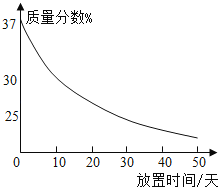
(1)实验室中有一瓶敞口放置的浓盐酸.它的质量分数和放置天数的关系如图.假设水不蒸发,分析浓盐酸的溶质质量分数变化的原因_____.
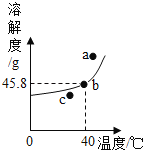
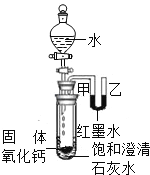
(2)观察图片,向小试管内滴加水后,除看到氧化钙固体溶解外,还可观察到的现象是_____.解释产生此现象的原因_____;_____.
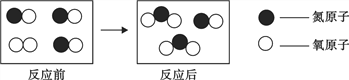
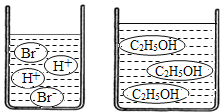
(3)如图分别是溴化氢(HBr)和乙醇(C2H5OH)在水中的微观示意图.请你结合已有的酸、碱知识,判断溴化氢的水溶液显_____,乙醇的水溶液显_____(填“酸性”、“中性”或“碱性”).
(4)向盛有10mL稀盐酸(其中滴有少量指示剂)的烧杯中加入氢氧化钠溶液,用pH计测定溶液的pH,所得数据如下.请分析并回答下列问题:
加入NaOH溶液的体积/mL | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 |
烧杯中溶液的pH | 1.1 | 1.2 | 1.4 | 1.6 | 2.5 | 7.0 | 11.0 | 12.0 |
①若滴加的指示剂是紫色石蕊溶液,当加入氢氧化钠溶液的体积为13mL时,溶液显_____色.
②若滴加指示剂是无色酚酞溶液,入氢氧化钠溶液充分振荡后,溶液颜色无变化.此时溶液中的溶质一定有(填化学式)_____;可能有_____.
【答案】浓盐酸易挥发 红墨水的液面乙高于甲、澄清石灰水变浑浊 氧化钙与水反应放热使试管内的气体受热膨胀 氢氧化钙的溶解度随温度的升高而降低,一部分氢氧化钙固体析出 . 酸性 中性 蓝色 NaCl HCl
【解析】
(1)分析图中盐酸的溶质质量分数随时间延长的变化情况,结合浓盐酸的挥发性,对这一现象进行解释;
(2)根据氧化钙遇水放出大量热,放出的热量可使装置内空气受热膨胀,也可使饱和溶液石灰水溶液温度升高,结合氢氧化钙的溶解性,预计会出现的现象并说明原因;
(3)溶液中含有H+,溶液呈酸性;溶液中含OH-,溶液则呈碱性;由图所示,根据溶液中粒子,判断两溶液的酸碱性;
(4)①由数据表,判断随着向稀盐酸中滴加氢氧化钠溶液pH的变化,根据变化规律,判断当加入氢氧化钠溶液的体积为13mL时,溶液的酸碱性及紫色石蕊的变色情况;
②酚酞遇酸或中性溶液均为无色,只有遇到碱性溶液才呈红色;根据酚酞的颜色,推断溶液中反应情况,判断溶液中溶质。
(1)图示表明,随时间延长盐酸的质量分数逐渐减小,这可用浓盐酸具有易挥发的性质加以解释:随HCl不断挥发,溶液中溶质质量减小;
(2)氧化钙遇水放出大量热,试管内空气受热膨胀,导管与之相通的U型管内两侧液面出现改变,红墨水的液面乙高于甲;放出的热量使大试管内盛放的饱和溶液温度升高,由于氢氧化钙溶解度随温度升高而减小,饱和溶液会因升温而析出固体,可观察到石灰水变浑浊;
(3)由图示可知,溴化氢的水溶液中含有H+,因此溶液呈酸性;而乙醇溶液中既不含H+也不含OH﹣,因此溶液呈中性;
(4)①紫色石蕊遇碱性溶液变成蓝色,根据表中数据可知,当滴入10mL氢氧化钠溶液中恰好完全反应,溶液呈中性;因此滴入13mL氢氧化钠溶液时,因氢氧化钠过量而使溶液呈碱性,因此紫色石蕊呈现蓝色;
②滴入一定量氢氧化钠溶液后,酚酞仍为无色,可推断此时的溶液可能含有未反应完的盐酸而呈酸性,或恰好完全反应而呈中性;因此,此时溶液中一定含反应生成的氯化钠,可能含有未完全反应的盐酸。

【题目】某校兴趣小组在实验室中完成制取氧气的实验。他们取氯酸钾和二氧化锰的混合物共6g放入大试管中加热,并在同时测定试管中剩余固体物质的质量(如下表),
请分析表中数据,完成下列问题:
反应时间/min | 1.0 | 2.0 | 3.0 | 4.0 | 5.0 |
剩余固体质量/g | 5.20 | 4.60 | 4.20 | 4.10 | 4.08 |
(1)完全反应时,生成氧气的质量为_____g;
(2)原混合物中氯酸钾的质量分数是__________?(计算结果精确到0.1%)
【题目】化学兴趣小组在实验室用氯酸钾和二氧化锰混合加热制取氧气进行探究。
实验一:氧气制取和性质实验现有如下装置:

(1)图D中用于收集气体的仪器是___________;
(2)检查A装置气密性的操作是________________;
(3)实验室用氯酸钾制氧气的化学式表达式为____________________,应选用的发生装置是________(用图中的序号,下同)和收集装置______。
实验二:某次在做该实验时偶然发现制得的气体有刺激性气味,这一现象引起了同学们的兴趣,于是在老师的指导下对该气体成分进行探究。
(提出问题)氯酸钾与二氧化锰混合加热后产生的气体成分是什么?
(查阅资料)①氯酸钾与二氧化锰混合加热产生的气体只以单质形式存在;
②氯气(Cl2)是有刺激性气味的气体,能溶于水,能使湿润的淀粉碘化钾试纸变蓝。
(4)(猜想假设)猜想一:该气体为O2;猜想二:该气体为___;猜想三:该气体为O2和Cl2的混合物。
(5)(实验探究)
序号 | 操作 | 现象 | 结论 |
方案一 | 用排水集气法收集甲、乙两瓶气体,将带火星的木条伸入甲瓶,湿润的淀粉碘化钾试纸伸入乙瓶。 | 木条复燃,淀粉碘化钾试纸不变色 | ①猜想__成立 |
方案二 | 向上排空气法收集甲、乙两瓶气体,将带火星的木条伸入甲瓶,湿润的淀粉碘化钾试纸伸入乙瓶。 | ②木条_____,淀粉碘化钾试纸为____色 | 猜想三成立 |
(6)(反思评价)为什么两种方案得出的结论不一致?哪个是正确的?
①同学:方案一结论不正确,其操作不合理,不合理之处是___________________。
②老师:不需要进行实验,就能排除猜想一,理由是________________________。
(拓展应用)
(7)实验结束后,该组同学准备回收固体剩余物中的不溶物二氧化锰,实验的主要步骤为:①溶解、②_____、③洗涤干燥。步骤②中玻璃棒的作用是______。
(8)氯气与水反应生成盐酸和次氯酸(HClO),写出该反应的化学式表达式:____________。
【题目】研究和控制化学反应条件有重要意义。
(1)同学们想探究双氧水的浓度对反应速率的影响。在其他条件相同的情况下进行了三次 实验,记录各收集一瓶相同体积氧气所需要的时间。
实验 | 30%双氧水的质量(g) | 加入的水的体积(mL) | 二氧化锰质量(g) | 收集时间(s) |
1 | 10 | 40 | 5 | 200 |
2 | 20 | 30 | 5 | 100 |
3 | 30 | 20 | __________ | 67 |
①写出上述反应的化学反应方程式__________。
②实验3中,加入的二氧化锰质量为__________g。
③该实验中氧气适宜采用__________方法进行收集,根据表中数据的分析,得出如下结论:相同条件下,实验3产生氧气的速率最快,说明__________。
(2)同学通过查阅资料得知,双氧水在70℃以上会较快分解产生氧气。为了验证加热双氧水也可以产生氧气,同学、 们选择如图装置(气密性良好)进行实验。实验中观察到试管内产生气泡,但将带火星的木条放在导管口没有复燃,可能的原因是__________,同学分析原因后,采用了__________法收集气体,再检验,证明加热双氧水也可产生氧气。

【题目】在一定条件下,在一个密闭容器内发生某反应,测得反应过程中各物质的质量如表所示,下列说法不正确的是( )
物质 | X | Y | Z | W |
反应前质量/g | 10 | 3 | 90 | 0 |
反应后质量/g | 3.2 | 3 | 待测 | 3.2 |
A. W可能是单质 B. Y可能是催化剂
C. 该反应是分解反应 D. 反应后Z物质的质量为![]()