题目内容
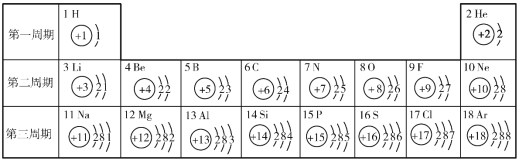
【题目】将一定量的乙醇和氧气置于一个完全封闭的容器中引燃,反应生成二氧化碳、水蒸气和一种未知物X.测得反应前后物质的质量如下表:
物质 | 乙醇 | 氧气 | 二氧化碳 | 水 | X |
反应前质量/g | 4.6 | 8 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 4.4 | 5.4 | m |
下列判断正确的是( )
A. 表中m的值无法确定
B. X可能是该反应的催化剂
C. 增加氧气的量可以减少X的生成
D. 物质X一定含有碳元素,可能含有氢元素
【答案】C
【解析】
4.6g乙醇中碳元素的质量为4.6g×![]() ×100%=2.4g,氢元素的质量为4.6g×
×100%=2.4g,氢元素的质量为4.6g×![]() ×100%=0.6g,氧元素的质量为4.6g2.4g0.6g=1.6g;4.4g二氧化碳中碳元素的质量为4.4g×
×100%=0.6g,氧元素的质量为4.6g2.4g0.6g=1.6g;4.4g二氧化碳中碳元素的质量为4.4g×![]() ×100%=1.2g,氧元素的质量为4.4g1.2g=3.2g;5.4g水中氢元素的质量为5.4g×
×100%=1.2g,氧元素的质量为4.4g1.2g=3.2g;5.4g水中氢元素的质量为5.4g×![]() ×100%=0.6g,氧元素的质量为5.4g0.6g=4.8g。4.6g乙醇中氢元素的质量与反应后生成水中的氢元素质量相同,所以X中不含氢元素;X中碳元素的质量为2.4g1.2g=1.2g;X中氧元素的质量为1.6g+8g3.2g4.8g=1.6g,则X中碳、氢质量比为1.2g:1.6g=3:4,则X为一氧化碳。
×100%=0.6g,氧元素的质量为5.4g0.6g=4.8g。4.6g乙醇中氢元素的质量与反应后生成水中的氢元素质量相同,所以X中不含氢元素;X中碳元素的质量为2.4g1.2g=1.2g;X中氧元素的质量为1.6g+8g3.2g4.8g=1.6g,则X中碳、氢质量比为1.2g:1.6g=3:4,则X为一氧化碳。
A、由质量守恒定律可知,m=4.6+84.45.4=2.8,选项错误;
B、由图可知,X的质量在反应后增加,则X不可能是催化剂,选项错误; ![]()
C、由分析可知,X为一氧化碳,乙醇燃烧时,增加氧气的量可以减少X(一氧化碳)的生成,选项正确;
D、由以上分析可知,X为一氧化碳,其中含碳元素,不含氢元素,选项错误,故选C。

 名校课堂系列答案
名校课堂系列答案【题目】某同学对蜡烛(主要成分是石蜡)及其燃烧进行了如下探究。

(1)取一支蜡烛,用小刀切下一小块,把它放入水中,蜡烛浮在水面上。结论:石蜡的密度比水_______ 。
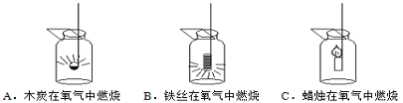
(2)点燃蜡烛,观察到蜡烛火焰分为外焰、内焰、焰心三层。把一根火柴梗放在蜡烛的火焰中(如图)约1s后取出,可以看到火柴梗的a处最先炭化。
结论:蜡烛火焰的_________层温度最高。
(3)探究蜡烛燃烧时发生的变化
实 验 步 骤 | 实 验 现 象 | 结 论 |
①点燃蜡烛,将光洁干燥的小烧杯罩在蜡烛 燃烧的火焰上方; ②将步骤(1)中的小烧杯取下,迅速向小烧杯中倒入少量_____________,振荡。 | ①__________ ②___________ | 蜡烛燃烧生成了 ____________ |
【题目】某校兴趣小组在实验室中完成制取氧气的实验。他们取氯酸钾和二氧化锰的混合物共6g放入大试管中加热,并在同时测定试管中剩余固体物质的质量(如下表),
请分析表中数据,完成下列问题:
反应时间/min | 1.0 | 2.0 | 3.0 | 4.0 | 5.0 |
剩余固体质量/g | 5.20 | 4.60 | 4.20 | 4.10 | 4.08 |
(1)完全反应时,生成氧气的质量为_____g;
(2)原混合物中氯酸钾的质量分数是__________?(计算结果精确到0.1%)