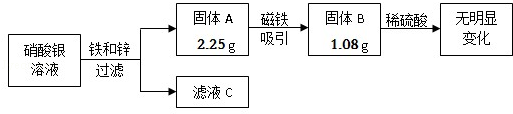
题目内容
用氯化钠和碳酸氢铵(NH4HCO3)可制备碳酸氢钠和氯化铵(NH4Cl),该反应可表示为:NaCl+NH4HCO3═NaHCO3+NH4Cl.
20℃时,按上述化学方程式中反应物的质量比,向100g水中加入11.7g NaCl
和15.8g NH4HCO3.请计算:
(1)理论上从溶液中析出晶体的质量为多少g?
(2)反应后所得溶液中溶质NH4Cl的质量分数是多少?(写出计算式即可).
资料:20℃时四种物质的溶解度如下,假设它们同时溶解在水中各自的溶解度不变.
20℃时,按上述化学方程式中反应物的质量比,向100g水中加入11.7g NaCl
和15.8g NH4HCO3.请计算:
(1)理论上从溶液中析出晶体的质量为多少g?
(2)反应后所得溶液中溶质NH4Cl的质量分数是多少?(写出计算式即可).
资料:20℃时四种物质的溶解度如下,假设它们同时溶解在水中各自的溶解度不变.
| 物质 | NaCl | NH4HCO3 | NH4Cl | NaHCO3 |
| 溶解度/g | 36.0 | 21.6 | 37.2 | 9.6 |
理论上从溶液中析出晶体的质量为7.2g;反应后所得溶液中溶质NH4Cl的质量分数是 ×100%.
×100%.
 ×100%.
×100%.试题分析:(1)根据化学方程式中质量关系可以知道:NaCl、NH4HCO3恰好完全反应,设生成的NaHCO3的质量为x,NH4Cl的质量为y
NaCl+NH4HCO3═NaHCO3+NH4Cl
58.5 79 84 53.5
11.7g x y
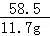 =
=
x=16.8g
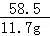 =
=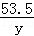
y=10.7g
根据题中的溶解度表可以知道,20℃时100g水中能够溶解碳酸氢钠的质量为9.6g,能够溶解氯化铵的质量为37.2g,所以理论上从溶液中析出的NaHCO3晶体的质量为16.8g﹣9.6g=7.2g;
(2)反应后溶液中溶质NH4Cl的质量分数为:
 ×100%;
×100%; 
练习册系列答案
相关题目