题目内容
为了测定某粉末状黄铜(铜、锌合金)样品中铜的质量分数,贝贝同学取10g黄铜样品放入烧杯中,再取40g稀盐酸分四次加入烧杯中,均充分反应,实验数据如下:
(1)该小组同学要用质量分数为36,5%浓盐酸配制所需的40克稀盐,则需浓盐酸的质量为_ ;
(2)上述反应的化学方程式为 ;
(3)列出求解生成氢气总质量(X)的比例式 ;
(4)向第一次反应后所得溶液中加入8.74g水,则所得溶液的质量分数为 ;
(5)某工厂要想制得2000t黄铜,需要含杂质50%的辉铜矿(主要成分是Cu2S)的质量为 .
| | 第一次 | 第二次 | 第二次 | 第四次 |
| 加入稀盐酸质量(g) | 10g | 10g | 10g | 10g |
| 剩余固体的质量(g) | 8.7g | 7.4g | 6.1g | 5.45g |
(1)该小组同学要用质量分数为36,5%浓盐酸配制所需的40克稀盐,则需浓盐酸的质量为_ ;
(2)上述反应的化学方程式为 ;
(3)列出求解生成氢气总质量(X)的比例式 ;
(4)向第一次反应后所得溶液中加入8.74g水,则所得溶液的质量分数为 ;
(5)某工厂要想制得2000t黄铜,需要含杂质50%的辉铜矿(主要成分是Cu2S)的质量为 .
(1)16g(2)Zn+2HCl═ZnCl2+H2↑(3)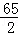 =
=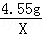 (4)13.6%(5)2725t
(4)13.6%(5)2725t
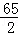 =
=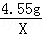 (4)13.6%(5)2725t
(4)13.6%(5)2725t 试题分析:(1)根据第一次数据计算,参加反应的锌的质量为:10g﹣8.7g=1.3g,
设10g稀盐酸中氯化氢的质量为X,生成氯化锌的质量为Z,生成氢气的质量为m,
Zn+2HCl═ZnCl2+H2↑,
65 73 136 2
1.3g X Z m
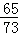 =
=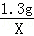 ,
,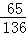 =
=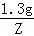 ,
,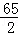 =
=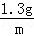 ,
,X=1.46g,Z=2.72g,m=0.04g,
稀盐酸的质量分数为:
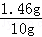 ×100%=14.6%,
×100%=14.6%,设需浓盐酸的质量为Y,
根据稀释前后溶质质量不变有:Y×36.5%=40g×14.6%,
Y=16g.故填:16g.
(2)上述反应的化学方程式为:Zn+2HCl═ZnCl2+H2↑.故填:Zn+2HCl═ZnCl2+H2↑.
(3)10g黄铜样品中锌的质量为:10g﹣5.45g=4.55g,
设生成氢气总质量为X,
Zn+2HCl═ZnCl2 +H2↑,
65 2
4.55g X
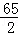 =
=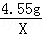 ,
,X=0.14g,故填:
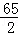 =
=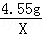 .
.(4)向第一次反应后所得溶液中加入8.74g水,则所得溶液的质量为:10g+1.3g﹣0.04g+8.74g=20g,
则所得溶液的质量分数为:
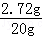 ×100%=13.6%.故填:13.6%.
×100%=13.6%.故填:13.6%.(5)由表中数据可知,铜的质量为5.45g,
黄铜样品中铜的质量分数为:
 ×100%=54.5%,
×100%=54.5%,2000t黄铜中铜的质量为:2000t×54.5%=1090t,
需要Cu2S的质量为:1090t÷(
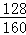 ×100%)=1362.5t,
×100%)=1362.5t,需要含杂质50%的辉铜矿的质量为:1362.5t÷50%=2725t.故填:2725t.

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
 2CuSO4 + 2H2O)现有溶质的质量分数为10%的稀硫酸(其中含溶质98 g)与铜恰好完全反应,假设硫酸不和其他杂质反应,求反应后硫酸铜溶液中溶质的质量分数。(最后结果精确到0.1%)
2CuSO4 + 2H2O)现有溶质的质量分数为10%的稀硫酸(其中含溶质98 g)与铜恰好完全反应,假设硫酸不和其他杂质反应,求反应后硫酸铜溶液中溶质的质量分数。(最后结果精确到0.1%)
