题目内容
【题目】某兴趣小组根据实验室提供的仪器和药品进行了氧气的制备实验。
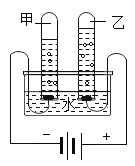
(1)甲同学选用如图所示的装置制取氧气。
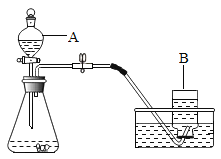
①写出A、B仪器的名称:A_________;B________。
②除用排水法外,甲同学还可选择_________法收集氧气。
③实验前,甲同学先向仪器A中加入水,然后将导管放入槽中,并打开仪器A的活塞,观察导管口是否有气泡出现。该实验操作的目的是___________。
(2)在用氯酸钾制取氧气的实验中,乙同学误把高锰酸钾当成了二氧化锰加入氯酸钾中,加热时,氯酸钾的分解速率明是加快,于是得出结论:高锰酸钾也可以作为氯酸钾分解的催化剂,大家经过讨论后,认为乙同学得出的结论不科学
①写出高锰酸钾制取氧气的化学方程式________,氯酸钾制取氧气的化学方程式________。
②如何证明高锰酸钾不是氯酸钾分解的催化剂_________。
③高锰酸钾能加快氯酸钾分解速率的主要原因是_________。
(3)丙同学称取一定质量的高锰酸钾放在大试管中,将温度控制在20℃条件下加热制取氧气,实验结束时,丙同学发现收集到的氧气大于理论产量,针对这一现象同学们进行了如下探究:
(提出猜想)
猜想Ⅰ:反应生成的二氧化锰分解放出氧气;
猜想Ⅱ:反应生成的锰酸钾分解放出氧气。
做出上述猜想的理由是_____________。
(实验验证)同学们分为两组,分别进行以下实验:
①第一组同学取一定质量的二氧化锰,在250℃条件下加热一段时间,冷却后测得二氧化锰的质量不变。则猜想_______错误。
②第二组同学取锰酸钾在250℃条件下加热,没有用测定质量的方法,而是将带火星的木条放在试管口,观察到__________现象,从而得出了猜想Ⅱ正确的结论。
【答案】分液漏斗 集气瓶 向上排空气 检查装置气密性 ![]()
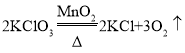 高锰酸钾在反应前后质量和化学性质都发生了改变 高锰酸钾分解生成的二氧化锰做催化剂 K2MnO4和MnO2都是含有氧元素的化合物 Ⅰ 木条复燃
高锰酸钾在反应前后质量和化学性质都发生了改变 高锰酸钾分解生成的二氧化锰做催化剂 K2MnO4和MnO2都是含有氧元素的化合物 Ⅰ 木条复燃
【解析】
(1)①图中A是分液漏斗,B是集气瓶;
②氧气的密度大于空气的密度,不易溶于水,所以除用排水法收集外,还可以用向上排空气法收集;
③实验前,甲同学先向仪器A中加入水,然后将导管放水槽中,并打开仪器A的活塞,观察导管口是否有连续的气泡出现。这种做法可以使装置内外形成压力差,操作的目的是检查装置气密性;
(2)①高锰酸钾受热分解生成锰酸钾和二氧化锰和氧气,反应的化学方程式是:![]() ;
;
氯酸钾在二氧化锰的催化作用下生成氯化钾和氧气,反应的化学方程式是: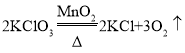 ;
;
②从催化剂的概念分析,催化剂在化学反应中质量和化学性质都不改变,本题中高锰酸钾分解了,那么本身的化学性质改变,自身分解了,质量当然也就发生了改变。所以高锰酸钾不是该反应的催化剂。
③由于高锰酸钾在加热时能够发生分解产生二氧化锰,这样氯酸钾和高锰酸钾的混合物在受热时高锰酸钾分解产生的二氧化锰就能够对氯酸钾的分解起到催化的作用其中的二氧化锰改变了氯酸钾的分解速率,所以充当催化剂的是二氧化锰,而非高锰酸钾。
(3)[提出猜想]
K2MnO4和MnO2都是含有氧元素的化合物,所以我们可以猜想有氧气生成。
[实验验证]
①第一组同学取一定质量的二氧化锰,在250℃条件下加热一段时间,冷却后测得二氧化锰的质量不变。则猜想Ⅰ错误;
②第二组同学取锰酸钾在250℃条件下加热,没有用测定质量的方法,而是将带火星的木条放在试管口,若木条复燃,则猜想Ⅱ正确。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案