��Ŀ����
����Ŀ��ij�о���ѧϰС���ͬѧ�õ��ˮ�ķ����ⶨˮ����ɺ�������⣺���ⶨˮ����ɻ��������ķ����𣿡��������ۺõ��˿϶��Ĵ𰸣�������һ��Դ�չ��̽����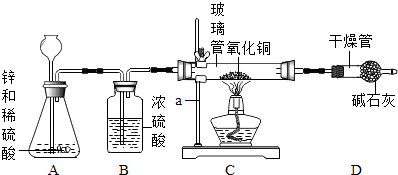
��1�����������ϡ�Dװ�����ι��м�ʯ�ҵ���Ҫ�ɷ����������ƺ������ƣ����Dz���������ˮ����������CO2 �� д������������ CO2��Ӧ�Ļ�ѧ����ʽ
��2������Ʒ�������ͬѧ����������ԭ����ͭ��ԭ������ͼװ�ü�ҩƷ����ʵ�飨�����淶����A װ���з�����Ӧ�Ļ�ѧ����ʽΪ�� ��
��3�����������������������й����ɺ�ɫת��Ϊ��ɫʱ��ʵ����ã�
��װ��C�IJ����ܺ����й�����������ڷ�Ӧ������� 1.6g��
��װ��D�ĸ���ܺ��������ʵ��������ڷ�Ӧ��������1.82g���ô��������ˮ��H��OԪ�ص�������Ϊ������ˮ�Ļ�ѧʽ��� H��OԪ�ص�������Ϊ ��
��4�������ݴ�������ʵ������в������� 0.2g��������ϡ���� 50g�������ݻ�ѧ����ʽ�����������Һ�����ʵ�����������
��5������������������������������ֵ��ƫ���ͬѧ��Ϊ����װ�ô���ȱ�ݣ��˹۵�õ��˴�ҵ���ͬ����Դ˸Ľ��ķ����ǣ��������ɵ�ˮ��ȫ�� D �м�ʯ�����գ�װ���ڿ����е�ˮ������CO2���Բ��ƣ���
���𰸡�
��1��2NaOH+CO2=Na2CO3+H2O
��2��Zn+H2SO4�TZnSO4+H2��
��3��1.1��8,1��8��
��4�����Ը�������Һ�����ʵ���������Ϊ19.6%��
��5����Dװ�ú���������һ�������
���������⣺���������ϡ��������ƺͶ�����̼��Ӧ����̼���ƺ�ˮ����ѧ����ʽΪ��2NaOH+CO2=Na2CO3+H2O��
����Ʒ�����п��ϡ���ᷴӦ��������п����������ѧ����ʽΪ��Zn+H2SO4�TZnSO4+H2����
���������������ݡ���װ��C�IJ����ܺ����й�����������ڷ�Ӧ�������1.6g����װ��D�ĸ���ܺ��������ʵ��������ڷ�Ӧ��������1.82g��������Ʋ����ˮ����Ԫ�ص�������1.6g����Ԫ�ص�������1.82g��1.6g=0.22g����ˮ��H��OԪ�ص�������Ϊ��0.22g��1.6g=1.1��8����ˮ�Ļ�ѧʽ���H��OԪ�ص�������Ϊ����1��2������16��1��=1��8��
�����ݴ�������μӷ�Ӧ����������Ϊx
Zn+ | H2SO4�TZnSO4+ | H2�� |
98 | 2 | |
x | 0.2g |
![]()
x=9.8g
���Ը�������Һ�����ʵ���������Ϊ�� ![]() ��100%=19.6%��
��100%=19.6%��
��������������Ϊ�����е�ˮ��������̼�����˸���ܣ�Ӱ���˽��������Ӧ����Dװ�ú���������һ������ܣ������ܹ���ֹ�����е�ˮ�Ͷ�����̼����D�У�
���Դ��ǣ����������ϡ�2NaOH+CO2=Na2CO3+H2O��
����Ʒ�����Zn+H2SO4�TZnSO4+H2����
������������1.1��8��1��8��
�����ݴ��������Ը�������Һ�����ʵ���������Ϊ19.6%��
��������������Dװ�ú���������һ������ܣ�
�����㾫����������Ҫ��������������ȡ�ͼ������д��ѧ����ʽ�����ֱ���ʽ�����뷽��ʽ�����֪ʶ�㣬��Ҫ����������ʵ�����Ʒ�ԭ����Zn + H2SO4 = ZnSO4 +H2����Zn + 2HCl = ZnCl2 +H2��������Ũ�����ԭ�� Ũ������ǿ�ӷ��� ��������Ũ����������ԭ�� Ũ�����������ǿ�����ԣ�ע�⣺a����ƽ b������ c�����Ų�����ȷ�����⣮

 ��ڽ��ȫ������ϵ�д�
��ڽ��ȫ������ϵ�д�