题目内容
【题目】现有氧化铜、氢氧化铜和硫酸铜的混合物20克,加入100克9.8%的稀硫酸恰好完全反应,反应结束后蒸发,所得硫酸铜的质量可能是( )
A. 35克B. 16克C. 27克D. 30克
【答案】C
【解析】
可以根据质量守恒定律,依据硫酸根的质量求出生成硫酸铜的质量;再利用极值法确定所得硫酸铜的质量。
氧化铜、氢氧化铜与硫酸反应后都生成硫酸铜,反应前后硫酸根的质量不变,硫酸的质量为:100g×9.8%=9.8g,硫酸根的质量为:9.8g×![]() ×100%=9.6g,设生成硫酸铜的质量为x,根据关系式:
×100%=9.6g,设生成硫酸铜的质量为x,根据关系式:
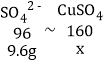
![]() 解得x=16g
解得x=16g
假设与稀硫酸反应的全部是氧化铜,设氧化铜的质量为m,则
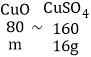
![]() 解得m=8g
解得m=8g
故混合物中硫酸铜的质量为:20g-8g=12g,所得硫酸铜的质量为:12g+16g=28g;
当与稀硫酸反应的全部是氢氧化铜时,设氢氧化铜的质量为n,则
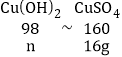
![]() 解得n=9.8g
解得n=9.8g
故混合物中硫酸铜的质量为:20g-9.8g=10.2g,所得硫酸铜的质量为:10.2g+16g=26.2g;
因为混合物20g氧化铜、氢氧化铜和硫酸铜的混合物,故所得硫酸铜的质量:26.2g~28g之间。
故选C。

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案
相关题目