题目内容
【题目】现有一小包白色固体,其中含有氧化钠和少量的氯化钙、硫酸钠。为了除去氯化钙、硫酸钠,得到纯净的氧化钠固体,同学们进行如下实验。
实验步骤 | 实验过程 |
溶解 | 将白色固体放入烧杯中,加入足量的水并用玻璃棒搅拌,得到澄清透明的溶液A。玻璃棒的作用是________。 |
除杂 | 第一步:向溶液A中加入过量的氧化钠溶液,产生白色沉淀,写出发生反应的化学方程式________。 加入过量的氧化钡溶液,目的是_ 第二步:充分反应后,再向其中加入过量的________溶液,观察到白色沉淀增多。 第三步:待上述混合物静置一段时间后,进行________(填操作名称),得到澄清的溶液B和白色沉淀。溶液B中的溶质是________。 |
蒸发 | 向溶液B中加入过量的稀盐酸,充分反应后将液体倒入蒸发皿中,当蒸发皿中出现________时,停止加热,即可得到纯净的氧化钠晶体。 |
(反思)有关物质除杂的问题,除了要选择正确的试剂,还要注意所加试剂的顺序。若将除杂操作中第一步和第: 步的顺序颠倒,后果是________。
【答案】搅拌Na2SO4+BaCl2![]() BaSO4↓+2NaCl氯化钡碳酸钠过滤碳酸钠和氯化钠较多的固体时
BaSO4↓+2NaCl氯化钡碳酸钠过滤碳酸钠和氯化钠较多的固体时
【解析】
(1)溶解过程中的玻璃棒起搅拌作用。
(2)向溶液A中加入过量的氯化钡溶液后,氯化钡与硫酸钠反应生成硫酸钡和氯化钠,反应方程式为Na2SO4+BaCl2![]() BaSO4↓+2NaCl;
BaSO4↓+2NaCl;
(3)反应中为了除去溶液中的硫酸钠,需要加入过量的氯化钡溶液;
(4)第一步反应后溶液中的杂质有过量的氯化钡和原溶液中的氯化钙,钡离子和钙离子都可以与碳酸根离子反应生成沉淀,故需要加入过量的碳酸钠溶液除去氯化钙和氯化钡;
(5)该步骤是将固体和液体分离的步骤,故是过滤。
(6)B溶液中的溶质是过量的碳酸钠和氯化钠。
(7)蒸发时,当蒸发皿中出现较多的固体时,就停止加热,利用余热将固体烘干。

【题目】为测定某黄铜(铜锌合金)样品中铜的含量,某化学活动小组分三次进行实验,实验数据如表,请回答下列问题:
所取药品 | 第一次 | 第二次 | 第三次 |
黄铜样品质量(g) | 12 | 10 | 10 |
稀盐酸质量(g) | 100 | 100 | 150 |
生成气体质量(g) | 0.2 | 0.2 | 0.2 |
(1)第____次实验中,药品成分恰好完全反应。
(2)黄铜样品中铜的质量分数是多少?恰好完全反应时所得溶液的溶质质量分数是多少________?(精确到0.1%)
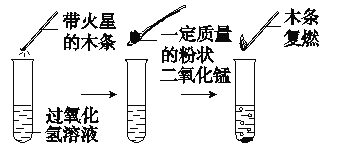
【题目】为探究催化剂对过氧化氢(H2O2)分解的催化效果,某研究小组做了如图所示的实验。
实验一:
实验二:数据记录表
1%过氧化氢溶液/mL | 50 | 50 | 50 |
加入二氧化锰的质量/g | 0.1 | 0.2 | 0.4 |
测量40 s末得到氧气的体积/mL |
实验一:图中的实验能否证明二氧化锰是过氧化氢分解反应的催化剂?并说明理由:__________。
实验二:从表格的设计可以看出,该实验的目的是____________。