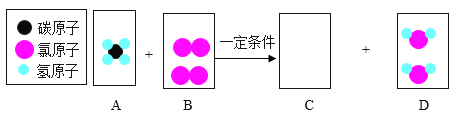
题目内容
【题目】兴趣小组设计实验验证草酸亚铁晶体热分解的气体产物,并用热重法(TG)确定其分解后所得固体产物的组成。
资料链接:①草酸亚铁晶体( FeC2O4﹒2H2O)是浅黄色、难溶于水、受热易分解的固体。
②无水硫酸铜遇水会变成蓝色。
探究一: 探究草酸亚铁晶体热分解的气体产物
[猜想假设]猜想一: X、CO2
猜想二: X、CO
猜想三: X、CO、CO2,物质X为________(填化学式)。
[设计实验]
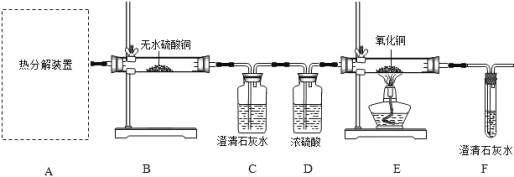
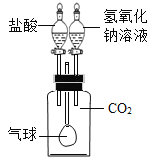
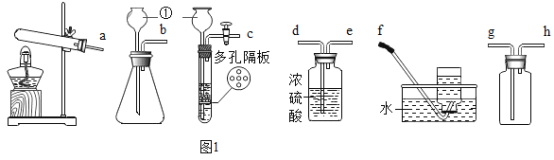
(1)选择_________(填字母序号)作为虚线中的“热分解装置”
A 过氧化氢分解制氧气的发生装置
B 氯酸钾分解制氧气的发生装置
(2)进行上述实验时,先点燃热分解装置中的酒精灯,一段时间后再点燃E处的酒精灯,原因是_________。
(3)D中浓硫酸的作用是________,实验过程中观察到______的现象,证明猜想三正确。
[交流讨论]
(1)C中反应的化学方程式为__________。
(2)该装置并不能严谨证明猜想三成立,改进的措施是在C和D装置之间增加盛有___(填 名称)溶液的洗气瓶。
探究二:热重法(TG)确定分解所得固体产物的组成
[数据分析]
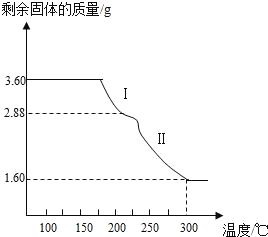
称取3.60g草酸亚铁晶体( FeC2O4﹒2H2O,为相对分子质量为180),用热重法对其进行热分解,得到剩余固体的质量随温度变化的曲线如图所示。300°C时,剩余固体为纯净物且是铁的氧化物,通过计算确定该物质的化学式为_________。
【答案】H2O B 把装置中空气排尽,避免CO和空气混合达到爆炸极限,加热时发生爆炸 干燥气体 B中白色无水CuSO4变成蓝色,C中澄清石灰水变浑浊,E中固体由黑变红 ![]() 浓氢氧化钠 Fe2O3
浓氢氧化钠 Fe2O3
【解析】
过氧化氢在二氧化锰催化作用下分解制氧气,反应在常温下进行,氯酸钾和二氧化锰加热分解制氧气,反应需要加热,草酸亚铁晶体受热分解,为固体加热装置,二氧化碳和氢氧化钙生成碳酸钙和水,二氧化碳和氢氧化钠反应生成碳酸钠和水。
[猜想假设] 草酸亚铁晶体( FeC2O4﹒2H2O)含有结晶水,则受热分解的气体可能是水蒸气,故物质X为水,化学式为H2O。
[设计实验]
(1)过氧化氢在二氧化锰催化作用下分解制氧气,反应在常温下进行,氯酸钾和二氧化锰加热分解制氧气,反应需要加热,草酸亚铁晶体受热分解,为固体加热装置,故选B。
(2)一氧化碳属于可燃性气体,不纯加热会发生爆炸,实验要排出装置中的空气,故进行上述实验时,先点燃热分解装置中的酒精灯,一段时间后再点燃E处的酒精灯,原因是把装置中空气排尽,避免CO和空气混合达到爆炸极限,加热时发生爆炸。
(3)浓硫酸具有吸水性,故D中浓硫酸的作用是干燥气体;
无水硫酸铜遇水变蓝色,故实验过程中观察到B中白色无水CuSO4变成蓝色的现象,证明生成的气体含水,二氧化碳能使澄清石灰水变浑浊,故观察到C中澄清石灰水变浑浊,说明生成的气体含二氧化碳,一氧化碳能与氧化铜在加热的条件下反应生成铜和二氧化碳,故E中固体由黑变红,说明生成的气体中含一氧化碳,故填:B中白色无水CuSO4变成蓝色,C中澄清石灰水变浑浊,E中固体由黑变红;
[交流讨论]
(1)C中反应是二氧化碳和氢氧化钙生成碳酸钙和水,反应的化学方程式为![]() 。
。
(2)二氧化碳和氢氧化钠反应生成碳酸钠和水,该装置并不能严谨证明猜想三成立,需要吸收二氧化碳,故改进的措施是在C和D装置之间增加盛有浓氢氧化钠溶液的洗气瓶。
[数据分析]
3.60g草酸亚铁晶体( FeC2O4﹒2H2O,为相对分子质量为180)中的铁元素的质量为
![]() ,氧化物中氧元素的质量为
,氧化物中氧元素的质量为![]() ,铁元素和氧元素的质量比为
,铁元素和氧元素的质量比为![]() ,设铁的氧化物的化学式为
,设铁的氧化物的化学式为![]() ,则
,则![]() ,
,![]() ,故铁的氧化物的化学式为
,故铁的氧化物的化学式为![]() 。
。

 发散思维新课堂系列答案
发散思维新课堂系列答案【题目】(1)某物质R完全燃烧的化学方程式为:2R+3O2![]() 2CO2+4H2O,R的相对分子质量等于__。R中碳、氢两种元素质量比等于__。__gR中氢元素质量和18g水氢元素质量相等。
2CO2+4H2O,R的相对分子质量等于__。R中碳、氢两种元素质量比等于__。__gR中氢元素质量和18g水氢元素质量相等。
(2)在一密闭容器内加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,反应前后各物质的质量变化见下表。下列说法中不正确的是_____。
物质 | 甲 | 乙 | 丙 | 丁 |
反应前物质质量/g | 8 | 32 | 5 | 4 |
反应后物质质量/g | 16 | 4 | x | 24 |
A 该反应为分解反应
B 甲、乙两种物质间参加反应的质量比为1:4
C 丙可能为该反应的催化剂
D 乙、丁两种物质间反应的质量比为7:5
【题目】某兴趣小组发现铁钉生锈速率较慢,询问老师如何加快铁钉生锈的速率。老师提出氯化 物可能加快铁钉生锈的速率。
(提出问题)氯化物对铁钉生锈有怎样的影响?
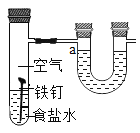
(实验探究一)探究氯化物对铁钉生锈速率的影响。
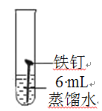
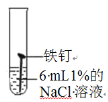
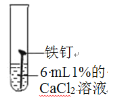
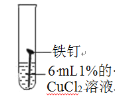
试管编号 | ① | ② | ③ | ④ |
实验 |
|
|
|
|
现象 | 2天后,铁钉表面出现红色 | 1天后, 铁钉表面出现红色 | 1天后,铁钉表面出现红色 | 7分钟时铁钉表面出出现红色20分钟后试管底部出现红色沉淀 |
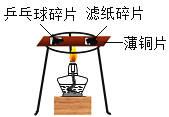
(1)分析实验①②③可以得到的结论是氯化物______(填“能”或“否”)加快铁生锈。
(2)小组同学认为,试管④中的红色沉淀可能是铁锈,也可能是铜。他们认为红色沉淀可能是铜的理由是_____(用化学方程式解释)。
(实验探究二)探究试管④中红色沉淀的物质组成。
实验步骤 | 实验操作 | 实验现象 |
I | 将试管④中的红色固体加入试管中,再向试管中加入足量的 | 红色固体大部分溶解,溶液变为黄色 |
II | 将步骤I所得的混合物过滤,洗涤、干燥滤纸上的固体后,置于石棉网上加热 | 红色固体变黑 |
III | 将步骤II所得的黑色固体置于管中,再加入足量稀硫酸 |
(3)步骤Ⅰ中所加入的试剂是______。
(4)步骤Ⅲ中观察到的实验现象是_____。
(5)由实验探究二分析试管④中红色沉淀的物质组成是________(填字母)。
A 只有铁锈 B 只有铜 C 铁锈和铜
(反思与应用)
(6)综上,该小组推测氯化物与铁钉生成的金属能进一步加快铁钉生锈,则在等体积、等浓度的 NaCl 溶液中,铁铜合金的生锈速率_____(填“快于”或“慢于”)纯铁的生锈速率。