题目内容
计算出化肥硝酸铵(NH4N03)和尿素[CO(NH2)2]的相对分子质量,并计算出各自的肥效?(肥效指氮元素的质量分数)哪种化肥的肥效大?
考点:相对分子质量的概念及其计算,元素的质量分数计算
专题:化学式的计算
分析:根据相对分子的质量为组成分子的各原子的相对原子质量之和,进行分析解答.
根据化合物中元素的质量分数=
×100%,进行分析解答.
根据化合物中元素的质量分数=
| 相对原子质量×原子个数 |
| 相对分子质量 |
解答:解:硝酸铵的相对分子质量为14×2+1×4+16×3=80.尿素的相对分子质量为12+16+(14+1×2)×2=60
硝酸铵中氮元素的质量分数为
×100%=35%;尿素中氮元素的质量分数为
×100%=46.7%,35%<46.7%,故尿素的肥效大;
答案:硝酸铵的相对分子质量为80;尿素的相对分子质量为60;
尿素的肥效大.
硝酸铵中氮元素的质量分数为
| 14×2 |
| 80 |
| 14×2 |
| 60 |
答案:硝酸铵的相对分子质量为80;尿素的相对分子质量为60;
尿素的肥效大.
点评:本题难度不大,考查同学们灵活运用化学式的有关计算进行分析问题、解决问题的能力.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案
相关题目
下列变化肯定属于化学变化的是( )
①物质发生爆炸 ②固体氢氧化钙露在空气中变重 ③酒精的燃烧 ④火柴梗蘸一点儿浓硫酸变黑 ⑤汽油挥发.
①物质发生爆炸 ②固体氢氧化钙露在空气中变重 ③酒精的燃烧 ④火柴梗蘸一点儿浓硫酸变黑 ⑤汽油挥发.
| A、②③④ | B、①②④ |
| C、①④⑤ | D、③⑤ |
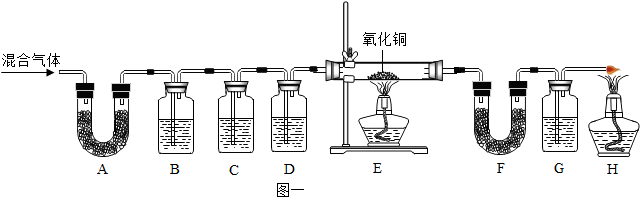
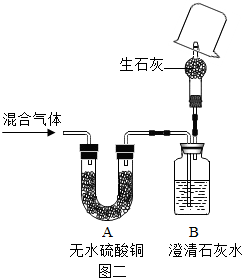
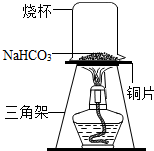 碳酸氢钠常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的热稳定性进行探究.
碳酸氢钠常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的热稳定性进行探究.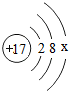 中x=
中x=
 ,该元素的原子核外有
,该元素的原子核外有