题目内容
清晨用自来水漱口时偶尔会闻到刺激性气味.小明带着好奇,对此展开系列探究,请你思考并完成相关问题.
【查阅资料】自来水的刺激性气味来源于杀菌、消毒剂
氯气.常温下溶于水中的部分氯气与水发生反应:H2O+Cl2=HClO+HCl.
HClO中氯元素的化合价是 .氯的原子结构示意图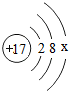 中x= ,氯离子核外有 个电子.
中x= ,氯离子核外有 个电子.
【实验探究】取刚溶解了氯气的水(称为氯水)少许于试管中,向其中滴入几滴紫色石蕊试液,石蕊试液由紫色变 色,接着颜色褪去.
【质疑】是什么物质使石蕊试液褪色的呢?
【分析】氯水中存在的物质有:H2O、Cl2、HClO、HCl,依据已有的化学知识,H2O、HCl不会使石蕊试液褪色,是Cl2或HClO或二者都能使石蕊试液褪色呢?
【实验方案】用如图所示实验装置进行实验.(图中铁架台等支持装置略去)
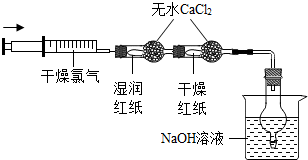
实验现象:湿润红纸条褪色,干燥红纸条不变色.
【交流讨论】该实验方案是采用 的思路设计的.实验中NaOH溶液的作用是吸收未反应完的氯气.请你分析氯气与水的反应,写出氯气与NaOH溶液反应的化学方程式: .
【探究结论】从上述实验可推测使有色物质褪色的是HClO而不是Cl2.
【查阅资料】自来水的刺激性气味来源于杀菌、消毒剂
氯气.常温下溶于水中的部分氯气与水发生反应:H2O+Cl2=HClO+HCl.
HClO中氯元素的化合价是
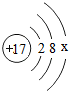 中x=
中x=【实验探究】取刚溶解了氯气的水(称为氯水)少许于试管中,向其中滴入几滴紫色石蕊试液,石蕊试液由紫色变
【质疑】是什么物质使石蕊试液褪色的呢?
【分析】氯水中存在的物质有:H2O、Cl2、HClO、HCl,依据已有的化学知识,H2O、HCl不会使石蕊试液褪色,是Cl2或HClO或二者都能使石蕊试液褪色呢?
【实验方案】用如图所示实验装置进行实验.(图中铁架台等支持装置略去)

实验现象:湿润红纸条褪色,干燥红纸条不变色.
【交流讨论】该实验方案是采用
【探究结论】从上述实验可推测使有色物质褪色的是HClO而不是Cl2.
考点:实验探究物质的性质或变化规律,原子结构示意图与离子结构示意图,有关元素化合价的计算,书写化学方程式、文字表达式、电离方程式
专题:科学探究
分析:【查阅资料】根据正负化合价代数和为零,在原子里质子数和核外电子数相等,氯原子最外层电子数为7,得一个电子后形成8个电子的稳定结构进行分析判断;
【实验探究】根据常温下溶于水中的部分氯气与水发生反应产物中有盐酸,盐酸显酸性,能使紫色石蕊溶液变红进行分析判断;
【交流讨论】根据装置中“干燥红纸和湿润红纸”中出现的现象不同,通过对照说明氯气不能使石蕊褪色,HClO能使石蕊褪色;由于氯气和水反应生成的两种物质都属于酸,都可以和氢氧化钠发生中和反应生成相应的盐(氢氧化钠和盐酸反应生成氯化钠,和HClO反应生成NaClO)和水进行分析判断;
【实验探究】根据常温下溶于水中的部分氯气与水发生反应产物中有盐酸,盐酸显酸性,能使紫色石蕊溶液变红进行分析判断;
【交流讨论】根据装置中“干燥红纸和湿润红纸”中出现的现象不同,通过对照说明氯气不能使石蕊褪色,HClO能使石蕊褪色;由于氯气和水反应生成的两种物质都属于酸,都可以和氢氧化钠发生中和反应生成相应的盐(氢氧化钠和盐酸反应生成氯化钠,和HClO反应生成NaClO)和水进行分析判断;
解答:解:【查阅资料】在HClO中,已知氢元素的化合价为+1,氧元素的化合价为-2,
设氯元素的化合价为X
根据正负化合价代数和为零.
+1+x+(-2)=0
x=+1;
在原子里质子数和核外电子数相等,所以X=17-2-8=7;氯原子最外层电子数为7,得一个电子后形成8个电子的稳定结构,变成离子,所以氯离子的核外有18个电子;故答案为:+1 7 18;
【实验探究】常温下溶于水中的部分氯气与水发生反应:H2O+Cl2═HClO+HCl.由于产物中有盐酸,盐酸显酸性,能使紫色石蕊溶液变红;故答案为:红;
【交流讨论】通过装置中“干燥红纸和湿润红纸”中出现的现象不同,前者不变色,说明氯气不能使石蕊褪色,后者红色消失,说明氯气和水反应生成的HClO使石蕊褪色,通过对照说明氯气不能使石蕊褪色,HClO能使石蕊褪色;由于氯气和水反应生成的两种物质都属于酸,都可以和氢氧化钠发生中和反应生成相应的盐(氢氧化钠和盐酸反应生成氯化钠,和HClO反应生成NaClO)和水;故答案为:对照实验 Cl2+2NaOH═NaCl+NaClO+H2O.
设氯元素的化合价为X
| +1x-2 |
| HClO |
根据正负化合价代数和为零.
+1+x+(-2)=0
x=+1;
在原子里质子数和核外电子数相等,所以X=17-2-8=7;氯原子最外层电子数为7,得一个电子后形成8个电子的稳定结构,变成离子,所以氯离子的核外有18个电子;故答案为:+1 7 18;
【实验探究】常温下溶于水中的部分氯气与水发生反应:H2O+Cl2═HClO+HCl.由于产物中有盐酸,盐酸显酸性,能使紫色石蕊溶液变红;故答案为:红;
【交流讨论】通过装置中“干燥红纸和湿润红纸”中出现的现象不同,前者不变色,说明氯气不能使石蕊褪色,后者红色消失,说明氯气和水反应生成的HClO使石蕊褪色,通过对照说明氯气不能使石蕊褪色,HClO能使石蕊褪色;由于氯气和水反应生成的两种物质都属于酸,都可以和氢氧化钠发生中和反应生成相应的盐(氢氧化钠和盐酸反应生成氯化钠,和HClO反应生成NaClO)和水;故答案为:对照实验 Cl2+2NaOH═NaCl+NaClO+H2O.
点评:本题综合性较强,考查学生化合价的求法,对题目中的信息的理解与应用及灵活运用进行分析问题、解决问题的能力.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案
相关题目
下列物质中几乎不含氧分子的是( )
| A、氧气 | B、液态氧 |
| C、蒸馏水 | D、空气 |