题目内容
【题目】将含有锌粉 6.5g、铁粉 5.6g、铜粉 3.2g、铝粉 0.9g 的混合物与一定质量的稀硫酸充分反应,反应停止后,有 6g 固体剩余。则生成氢气的质量为( )
A. 0.5gB. 0.3gC. 0.6gD. 0.4g
【答案】D
【解析】
根据金属活动性以及金属活动性优先原则可知,不反应的是铜粉,最先反应的是铝,其次是锌,再次是铁,由于剩余固体为6g,所以包含铜粉3.2g,则剩余铁粉质量为6g﹣3.2g=2.8g,则反应的铁的质量为5.6g﹣2.8g=2.8g。
不反应的是铜粉,最先反应的是铝,其次是锌,再次是铁,由于剩余固体为6g,所以包含铜粉3.2g,则剩余铁粉质量为6g﹣3.2g=2.8g,则反应的铁的质量为5.6g﹣2.8g=2.8g。
反应6.5g锌,生成氢气的质量为0.2g
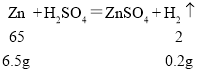
反应0.9g的铝,生成氢气质量为0.1g
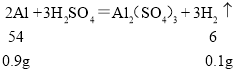
2.8g的铁反应,生成氢气0.1g
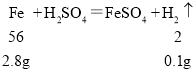
所以生成氢气的总质量为0.2g+0.1g+0.1g=0.4g,故选D。

练习册系列答案
相关题目