题目内容
【题目】碘是人体必需的微量元素之一。下图是元素周期表中提供的碘元素的部分信息及碘原子的结构示意图。下列说法错误的是
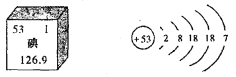
A.碘的相对原子质量为126.9,原子核内质子数为53
B.碘原子核外共有53个电子,最外层有7个电子
C.碘元素属于非金属元素,碘原子在化学反应中易得电子
D.碘盐中含有碘酸钾(KIO3),KIO3中碘元素的化合价为一1价
【答案】D
【解析】
试题分析:A.碘的相对原子质量为126.9,原子核内质子数为53,正确;B、质子数与核外电子数相等,则碘原子核外共有53个电子,最外层有7个电子,正确;C、碘元素属于非金属元素,碘原子最外层电子数大于4,在化学反应中易得电子,正确;D、KIO3中碘元素的化合价为+5价,错误。故选D

 世纪百通主体课堂小学课时同步达标系列答案
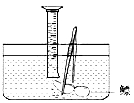
世纪百通主体课堂小学课时同步达标系列答案【题目】常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应生成一种常见铁的氧化物和一种气体。小明很好奇,设计如下实验探究铁粉与水蒸气反虚后的产物。
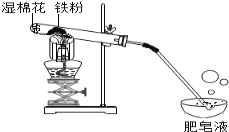
(1)试管尾部放一团湿棉花的目的是_____________
(2)探究生成的气体是什么?
用燃着的木条靠近肥皂泡,有爆鸣声,稍后有肥皂泡飘到空中。
说明生成的气体是______________
(3)探究试管中剩余固体成分是什么?
【查阅资料】
常见铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
颜色、状态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
能否被磁铁吸引 | 否 | 否 | 能 |
还查阅到 Fe3O4能和稀盐酸发生反应,生成金属化合物和水
【初步验证】试管中剩余固体为黑色,能全部被磁铁吸引。
【猜想与假设】猜想一:剩余固体是Fe与Fe3O4;猜想二:剩余固体是_____________
【实验探究】
实验操作 | 实验现象及结论 |
若固体全部溶解,没有气泡冒出,剩余固体是Fe3O4.若固体全部溶解,有气泡冒出,剩余固体是Fe与Fe3O4. |
【实验结论】铁和水蒸气反应的化学方程式为___________________________________
【反思与交流】该黑色固体不可能是Fe2O3,理由是_______________________________