题目内容
【题目】(6分)下图是某化学小组配制50g溶质质量分数为16%的氯化钠溶液的实验操作示意图:
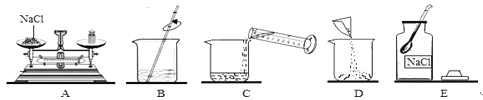
请回答下列问题:
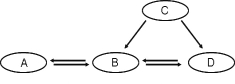
(1)上图所示操作中正确的顺序为_________________________(填序号);步骤B中玻璃棒的作用是___________________________________;
(2)经计算,配制该溶液需要氯化钠的质量为 g;若称量时A出现了右盘偏低的现象,接下来的操作应该是____(填序号)
①调节平衡螺母 ②减少左盘中食盐
③减少右盘中砝码 ④增加左盘中食盐
(3)配制时应选择 (填写“10”、“50”或“100”)mL量筒量取所需要的水(水的密度是1.0g/cm3);若在量取水时俯视凹液面最低处,其它操作正确,则所得溶液的溶质质量分数为________16%(填“>”、“=”或“<”);
【答案】(1) EADCB;搅拌,加速溶解;(2) 8;④;(3)50;>.
【解析】(1)配制溶液时,先计算溶质、溶剂的质量,再用天平称量固体,用量筒量取液体,最后溶解,故实验步骤为:EADCB;步骤B中玻璃棒的作用是搅拌,加速溶解的作用;
(2)经计算,配制该溶液需要氯化钠的质量为50g×16%=8g;若称量时A出现了右盘偏低的现象,说明药品的量不足,接下来的操作应该是继续添加药品,故选④;
(3)因为所需水的体积不足50mL,所以配制时应选择50mL量筒量取所需要的水(水的密度是1.0g/cm3);若在量取水时俯视凹液面最低处,量取水的体积会偏小,导致溶质质量分数偏大,若其它操作正确,则所得溶液的溶质质量分数>16%
试题分析:根据配置一定溶质质量分数溶液的步骤为:计算、称量、量取、溶解分析;根据玻璃棒在溶解中的主要是搅拌分析;根据溶质质量=溶液质量×溶质质量分数计算,根据天平称量固体遵循“左物右码”,右端偏低说明药品量不足分析;根据量筒的选择方法是选择与量取液体体积最接近且一次量取的量程分析;根据量取水时俯视凹液面最低处,量取水的体积会偏小分析.

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案