题目内容
【题目】(5分)海洋是巨大的资源宝库,为人类提供了宝贵的自然资源。
(1)海水中含量最多的阴离子是_____(写离子符号)。
(2)我国化学科学家侯德榜创立的“侯氏制碱法”,就是以海水“晒盐”得到的氯化钠为原料,同时制得Na2CO3
和NH4Cl产品。Na2CO3和NH4Cl的溶解度曲线如图所示。回答下列问题:
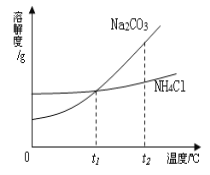
①t2℃时,NH4Cl饱和溶液的溶质质量分数_______Na2CO3饱和溶液的溶质质量分数(填“大于”、“小于”、“等于”之一)。
②若使溶液由不饱和溶液转化为饱和溶液,可以采用的方法是_______________。(写一种即可)
③t1℃时一小试管内盛有的Na2CO3饱和溶液,试管底部还存有少许Na2CO3固体,将小试管放入盛有水的烧杯内,向烧杯内的水中加入一种固体物质X,发现小试管内的固体物质逐渐溶解,根据所学知识推断所加物质X可能是______(填化学式),小试管内固体物质逐渐溶解的原因是_______________________________。
【答案】(1)Cl-;(2) ①小于;②增加溶质;③NaOH;氢氧化钠溶于水放出热量,使溶液温度升高,从而使碳酸钠的溶解度也增大.
【解析】(1)海水中含量最多物质是氯化钠,所以含量最多的阴离子是Cl-;
(2)① t2℃时,NH4Cl的溶解度小于碳酸钠的溶解度,所其饱和溶液的溶质质量分数小于Na2CO3饱和溶液的溶质质量分数;②若使溶液由不饱和溶液转化为饱和溶液,可以采用的方法有增加溶质、蒸发溶剂等;③因为碳酸钠的溶解度随温度的升高而增大,所以试管中未溶解碳酸钠又继续溶解,说明加入X后溶液温度升高,证明X溶于水放热,因此该物质可能是生石灰或氢氧化钠固体;
试题分析:根据海水中含量最多的是氯化钠分析;根据溶解度曲线提供的信息可知t2℃时,NH4Cl的溶解度小于碳酸钠的溶解度,根据饱和溶液中溶质质量分数=![]() 分析;根据使溶液由不饱和溶液转化为饱和溶液,可以采用增加溶质、蒸发溶剂等方法分析;根据碳酸钠的溶解度随温度的升高而增大,所以试管中未溶解碳酸钠又继续溶解,说明加入X后溶液温度升高,证明X溶于水放热分析.
分析;根据使溶液由不饱和溶液转化为饱和溶液,可以采用增加溶质、蒸发溶剂等方法分析;根据碳酸钠的溶解度随温度的升高而增大,所以试管中未溶解碳酸钠又继续溶解,说明加入X后溶液温度升高,证明X溶于水放热分析.
考点:溶解度曲线表示的意义;饱和溶液与不饱和溶液的转化关系;溶质质量分数的计算方法