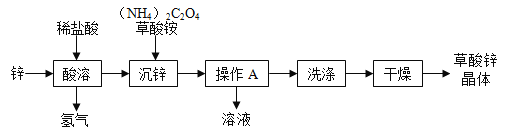
题目内容
【题目】为确定曝露于空气中的氢氧化钠固体样品的成分,实验小组进行下列探究活动:
(提出问题)固体样品的成分是什么?
(猜想与假设)秦思:氢氧化钠
石建:氢氧化钠和碳酸钠
单杰:碳酸钠 石建猜想的依据是____。
(实验探究)为证明猜想,小组同学进行实验如下:
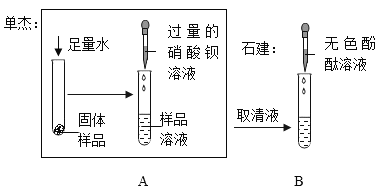
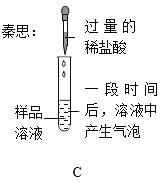
(评价与反思)根据实验A中产生白色沉淀的现象,单杰认为自己的猜想正确。石建对单杰的实验A及得出结论的可靠性提出质疑,理由是_____。石建在单杰实验的基础上继续实验B并结合B中溶液颜色的变化,证明自己的猜想正确。单杰对自己实验存在的问题进行反思与改进,提出在实验A基础上若将实验B中的无色酚酞溶液换成 ________(填一种试剂的名称),产生白色沉淀,据此现象也可证明石建的猜想正确的实验设想。
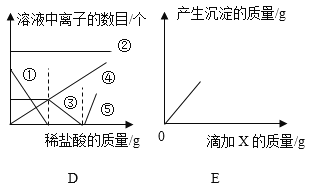
(解释与结论)秦思进行实验C,滴加过量稀盐酸过程中溶液中离子的数目变化如图D, 据此,得出和石建相同的实验结论。图中①表示的是_(填符号),③表示的是_____(填符号)。
(实验处理)将上述石建和秦思实验所得的液体混合,溶液仍为红色,向其中滴加适量的某酸X,产生白色沉淀的质量变化如图E,产生此现象一定发生反应的化学方程式为____;至溶液恰好变为无色时,实现绿色排放,最终液体中一定含有的离子是_(填符号)。
(归纳总结)经历上述探究过程,通过归纳,可以总结出:酸、碱、盐之间发生的复分解反应就是不同阴、阳离子结合成水或沉淀或气体的过程。通过比较,可以发现:当所加试剂中的一种离子与溶液中可能存在的两种离子都能结合时,要考虑 _____。在证明溶液中可能存在的离子是否存在时,不能引入与之前加入的离子能结合并_____,才能得出正确的结论。
【答案】氢氧化钠部分变质 无法验证氢氧化钠是否存在 MgCl2 OH- CO32- ![]() ;
;![]() Na+、NO3-、Cl- 生成物性质 产生相似实验现象
Na+、NO3-、Cl- 生成物性质 产生相似实验现象
【解析】
[猜想假设]
氢氧化钠与二氧化碳反应生成碳酸钠和水,若氢氧化钠部分变质,则固体就是氢氧化钠和碳酸钠;
故答案为:氢氧化钠部分变质。
[评价与反思]
碳酸钠与硝酸钡反应生成碳酸钡沉淀和硝酸钠,只能证明有碳酸钠的存在,氢氧化钠与硝酸钡不发生反应,没有明显现象,无法验证是否存在氢氧化钠,所以不能直接得出固体为碳酸钠;将酚酞换为另一种试剂,产生白色沉淀,证明氢氧化钠的存在,结合氢氧根离子与镁离子生成氢氧化镁沉淀的性质选择替代的试剂,因此含有镁离子的可溶性试剂可以为氯化镁,化学式为MgCl2;
故答案为:无法验证氢氧化钠是否存在;MgCl2。
[解释与结论]
盐酸与氢氧化钠反应生成氯化钠和水,盐酸与碳酸钠反应生成生成氯化钠、水和二氧化碳,盐酸加入后,先与氢氧化钠反应,因此只要盐酸加入,氢氧根离子就在减少,直至盐酸将其全部反应完毕,溶液中不存在氢氧根离子,所以①为氢氧根离子,此时再加入盐酸,盐酸与碳酸钠反应,碳酸根离子此时才开始减少,直至盐酸与碳酸根全部反应完毕,碳酸根离子不再溶液存在,所以③表示碳酸根离子;
故答案为:OH-;CO32-。
[实验处理]
混合后溶液为红色,说明溶液显碱性,此时溶质为硝酸钡、硝酸钠、氢氧化钠、氯化钠,要直接排放需要加入酸中和氢氧化钠,而加入的酸可形成白色沉淀,只有硫酸,硫酸与氢氧化钠反应生成硫酸钠和水,硫酸钠与硝酸钡反应生成硫酸钡沉淀和硝酸钠,由于酸碱中和反应先与复分解反应发生,所以当有白色沉淀生成时,一定是两个反应都发生了,据此书写化学方程式;当溶液恰好变为无色时,硫酸将氢氧化钠全部中和完毕,溶液显中性,而已排放,此时硫酸与氢氧化钠完全反应生成了硫酸钠和水,硫酸钠与硝酸钡反应生成硫酸钡沉淀和硝酸钠,因此硝酸钠一定存在,还有之前生成的氯化钠也存在,至于硫酸钠与硝酸钡是否有剩余无法判断,因此一定存在的离子有硝酸根离子、钠离子、氯离子;
故答案为:![]() ;
;![]() ;Na+、NO3-、Cl-。
;Na+、NO3-、Cl-。
[归纳总结]
当发现加入的试剂中一种离子与可能存在的两种离子都发生反应时,为了确定两种离子都存在,需要考虑加入与两种离子反应后生成物的性质,然后加入试剂进行验证;为了验证可能存在的离子,加入试剂后,不能与之前存在的离子发生反应,产生与检验离子相似的实验现象,否则无法验证是猜测离子造成的还是已有离子造成的;
故答案为:生成物性质;产生相似实验现象。